
【题目】利用如图装置测定中和热的实验步骤如下:
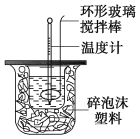
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): ______。
(2)倒入NaOH溶液的正确操作是________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ____________________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②上述实验测量结果得出的中和热的数值与57.3 kJ/mol相比偏小,产生的原因可能是(填字母)_________。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol C D 3.4 acd
Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol C D 3.4 acd
【解析】
(1)根据中和热的定义书写热化学方程式;
(2)为防止热量散失,需要将NaOH溶液一次性迅速倒入;
(3)酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使硫酸与NaOH溶液混合均匀;
(4)①先判断温度差的有效性,然后求出温度差平均值;
②a. 装置保温、隔热效果差,测得的热量偏小;
b. 量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大;
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中,测得的热量偏小;
d. 温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,因发生反应放出部分热量,导致硫酸的起始温度偏高。
(1)中和热是指在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热,其中和热数值为57.3 kJ/mol,则稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,
Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,
故答案为![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)中和热测定实验成败的关键是保温工作,沿玻璃棒缓慢倒入或分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多,故倒入NaOH溶液的正确操作是一次性迅速倒入,
答案为:C;
(3)使硫酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动,
故答案为D;
(4)①因第2组数值差别大,误差大,所以数据无效,不可取,则温度差平均值 = ![]() = 3.4,
= 3.4,
故答案为3.4;
②a. 装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b. 量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,NaOH仍稍过量,确保硫酸完全反应,故b错误;
c. 尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,分多次倒入NaOH溶液,热量损失较多,所测中和热的数值偏小,故c正确;
d. 温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确。
故答案为acd。


科目:高中化学 来源: 题型:
【题目】25°C 时,向 20 mL 0.10 molL-1的一元酸 HA 中逐滴加入 0.10 molL-1 NaOH 溶液,溶液 pH随加入 NaOH 溶液体积的变化关系如图所示。下列说法正确的是( )

A.HA为强酸
B.a点溶液中,c(A-)>c(Na+)>c(H+)>c(OH-)
C.酸碱指示剂可以选择甲基橙或酚酞
D.b点溶液中,c(Na+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是

A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C. a mol C和a mol H2O反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g)2Z(g) ΔH=-a kJ·molˉ1,一定条件下,将1 mol X和3 mol Y通入2 L的恒容密闭容器中,反应10 min,测得Y的物质的量为2.4 mol。下列说法正确的是
A. 10 min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
B. 第10 min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C. 10 min内,消耗0.2 mol X,生成0.4 mol Z
D. 第10 min时,Z的物质的量浓度为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某氨水中加入醋酸溶液,反应方程式如下:NH3·H2O+CH3COOH=CH3COONH4+H2O滴加过程,溶液的导电能力(I)与加入醋酸溶液的体积(V)关系正确的是( )
A.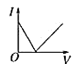 B.
B.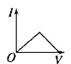 C.
C.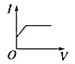 D.
D.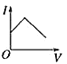
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A. NO2由反应N2+2O2![]() 2NO2生成
2NO2生成
B. 总反应可表示为2SO2+O2+2H2O![]() 2H2SO4
2H2SO4
C. 还可能发生的反应有4NO2+O2+2H2O=4HNO3
D. 还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是

A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡HIn(aq,红色) ![]() H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com