
| A、0.2mol/L?S |
| B、0.4mol/L?S |
| C、0.6mol/L?S |
| D、0.8mol/L?S |
科目:高中化学 来源: 题型:
| A、H-CHO |
| B、C6H5OH |
| C、C6H5CH2OH |
| D、C6H5COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
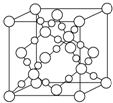 A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.005 mol?L-1?s-1 |
| B、v(C)=0.02 mol?L-1?s-1 |
| C、v(B)=v(A)/3 |
| D、v(A)=0.01 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
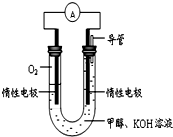 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的化学式为CuS,它既是氧化产物又是还原产物 |
| B、5 mol FeS2发生反应,有10 mol电子转移 |
| C、产物中的SO42-离子有一部分是氧化产物 |
| D、FeS2只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molCl2与足量的氢氧化钠溶液反应转移的电子数为0.2 NA |
| B、12.5mL 16mol/L浓硫酸与足量铜反应,转移的电子数为0.2NA |
| C、6.2g氧化钠和7.8g过氧化钠中所含有的离子数均为0.3 NA |
| D、2.24L氯气与氢氧化钠溶液完全反应转移的电子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com