
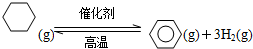
| [C6H6][H2]3 |
| [C6H12] |
| b×(3b)3 |
| a-b |
| 27b4 |
| a-b |
| 27b4 |
| a-b |
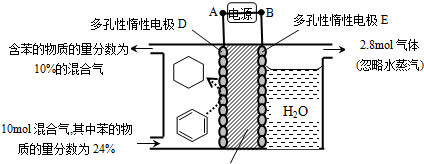
| 10mol×24%-x |
| 10mol-3xmol+5.6mol |
| 7.2mol |
| 11.2mol |


科目:高中化学 来源: 题型:
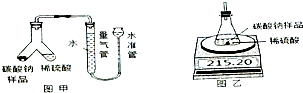 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验:| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.20 | 211.40 | 208.60 | 208.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
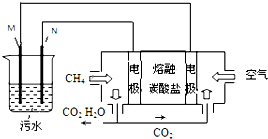 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 装置 |  | 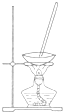 |  | 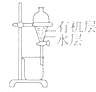 |
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com