
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | 0 |
 ;
; ;
;
|


科目:高中化学 来源: 题型:
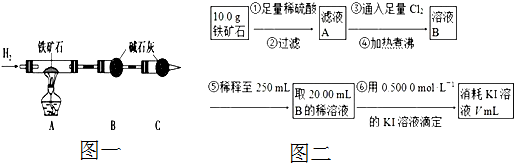
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(s)+H2(g) | K3 | ? | ? |
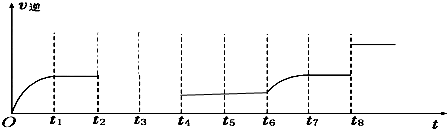
查看答案和解析>>
科目:高中化学 来源: 题型:
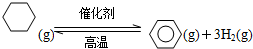
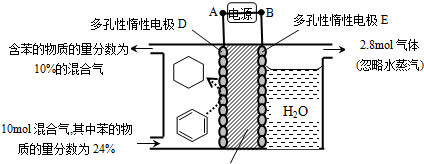
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 物质 | 杂质 | 试剂 | 主要操作 |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | CO2 | CO | O2 | 点燃 |
| C | FeCl2溶液 | FeCl3 | Cu | 过滤 |
| D | CH3CH2OH | H2O | Na | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
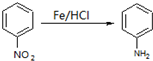
| 50℃ |
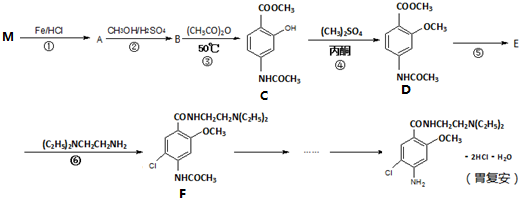
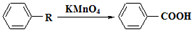 ,参照上述合成路线中的有关信息,写出由对甲苯酚为原料合成
,参照上述合成路线中的有关信息,写出由对甲苯酚为原料合成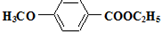 的合成流程图(其它试剂自选)
的合成流程图(其它试剂自选)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com