
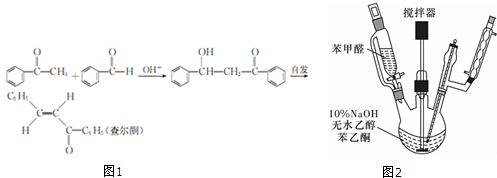
| m |
| M |
| 1.04g/mL×10.2mL |
| 106g/mol |
| 1.0281g/mL×17.5mL |
| 120g/mol |
| 10.4g |
| 208g/mol×0.10mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 现象及解释 |
| A | 过量铁粉逐渐加入到一定量的浓硝酸中 | 溶液最终变为浅绿色是因为浓硝酸变稀后,稀硝酸只能把铁氧化成Fe2+:Fe+2H+═Fe2++H2↑ |
| B | 向水杨酸(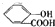 )中液加NaHCO3溶液 )中液加NaHCO3溶液 | 放出无色气体是因为水杨酸的酸性强于碳酸,反应生成CO2气体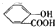 +2HCO3-═ +2HCO3-═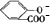 +2CO2↑+2H2O, +2CO2↑+2H2O, |
| C | 利用右边装置完成碳酸、醋酸和硅酸的酸性强弱比较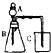 | B中固体溶解并产生气泡,C中出现白色沉淀是因为酸性:醋酸碳酸大于硅酸;B中离子方程式:CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 含有等浓度的SO42-和CO32-的溶液中滴加BaCl2溶液,将沉淀一分为二,一份经检验只含BaSO4,另一份放入饱和碳酸钠溶液一段时间,取出沉淀洗涤后放入盐酸中 | 放入盐酸中的沉淀溶解,且有气泡产生是因为Ksp[BaSO4]=1.1×10-30<Ksp[BaCO3]=5.1×10-9,因此SO42-先沉淀.但二者溶度积相差不大,BaSO4(s)+CO32-?BaCO3(s)+SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、CO2、CO、NO2都是酸性氧化物 |
| B、Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 |
| C、HCl、HClO、HNO3、HClO4都是强酸 |
| D、NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
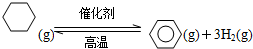
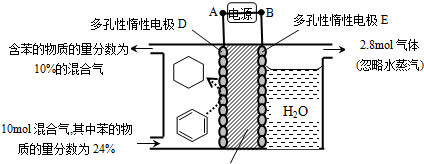
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应将溶液蒸干 |
| D、称量NaOH,称量物放在小烧杯中置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com