
【题目】利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧食盐样品时,钠的焰色为( )
A.黄色B.红色C.紫色D.绿色
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】医生常给脱水病人注射0.9%的生理盐水,而不注射蒸馏水或浓度更高的浓盐水。这是因为
A. 水分子容易进出细跑
B. 无机盐离子容易进出细胞
C. 过多或过少都对红细胞有害
D. 无机盐对维持细胞的形态和生理功能有重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 稀硫酸和氢氧化钡溶液反应: H++SO42-+Ba2++OH-=BaSO4↓+H2O
B. 氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. NaOH溶液中通入过量CO2:OH-+CO2 = HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列划线物质在化学反应中能被完全消耗的是( )
A. 用40 mL 10 mol/L浓盐酸与8.7 g 二氧化锰共热制取氯气
B. 标况下,将2.7 g 铝片投入到20 mL 18 mol/L的浓硫酸中
C. 向120 mL 2 mol/L 的盐酸中加入5.6g 铁
D. 向Ba(OH)2和NaOH各0.1 mol的混合溶液中通入标准状况下2.24 L CO2 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
CO(g)+3H2(g)![]() CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
写出CO与H2O (g)反应生成H2和CO2的热化学方程式____________________________________。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是______________。
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为_______________,此反应的平衡常数为__________________(结果保留到小数点后三位)
②下列说法中能说明此反应达到平衡状态的是____________。
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)![]() CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1
①分析适当增大水醇比[n(H2O) ∶n (CH3OH)]对甲醇水蒸气重整制氢的好处____________。
②某温度下,将[n(H2O) ∶n (CH3OH)]=l∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢气体生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。
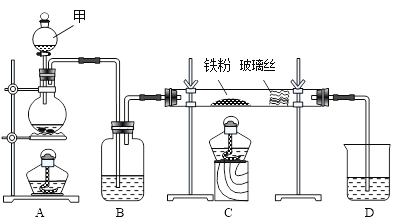
回答下列问题:
(1)制取无水氯化铁实验中,仪器甲的名称为_______________,进行实验时,应先点燃___________(选填A或C)处酒精灯。
(2)制取无水氯化铁的实验中,A中反应的离子方程式为_______________________,装置B中加入的试剂是____________________。
(3)制取的无水氯化铁中混有少量氯化亚铁,其原因是__________________(化学方程式表示)。为除去氯气中混有的少量HCl,可以在装置A、B间加入装有_______________的洗气瓶。
(4)工业上常用石灰乳吸收制氯气的尾气制得漂白粉,漂白粉的有效成分是_____________(填化学式)。长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_____________(填数字代号)。
① O2 ② Cl2 ③ CO2 ④ HClO
(5)制取无水氯化亚铁实验中,装置A用来制取HCl气体,其化学方程式为:NaCl +H2SO4 (浓) ![]() NaHSO4+ HCl↑,通过装置C后尾气的成分是_________________。若仍用D的装置进行尾气处理,存在的主要问题是_________________________________________。
NaHSO4+ HCl↑,通过装置C后尾气的成分是_________________。若仍用D的装置进行尾气处理,存在的主要问题是_________________________________________。
(6)制取无水氯化亚铁实验中,若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是________________。(填化学式)欲制得纯净的FeCl2,在实验操作中应先__________________________,再___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是![]() 的两个性质实验,下列有关说法中正确的是
的两个性质实验,下列有关说法中正确的是![]()
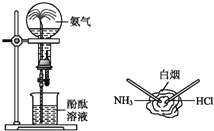
A. 两个实验均表现了![]() 易溶于水
易溶于水
B. 两个实验均表现了![]() 易挥发
易挥发
C. 两个实验均表现了![]() 是碱性气体
是碱性气体
D. 两个实验均表现了![]() 是还原性气体
是还原性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料.水泥熟料的主要成分为![]() 、
、![]() ,并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
,并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
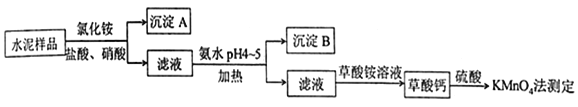
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸.加入硝酸的目的是________,还可使用________代替硝酸.
(2)沉淀![]() 的主要成分是________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为_____________________________________________
的主要成分是________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为_____________________________________________
(3)加氨水过程中加热的目的是__________________.沉淀![]() 的主要成分为________、________(填化学式).
的主要成分为________、________(填化学式).
(4)草酸钙沉淀经稀![]() 处理后,用
处理后,用![]() 标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:
标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() .实验中称取
.实验中称取![]() 水泥样品,滴定时消耗了
水泥样品,滴定时消耗了![]() 的
的![]() 溶液
溶液![]() ,则该水泥样品中钙的质量分数为________.
,则该水泥样品中钙的质量分数为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com