
【题目】已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下可分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系,若溶液中只有NaCl、NaClO、NaClO3三种溶质。下列判断不正确的是
A.反应过程中消耗氯气与NaOH的物质的量之比为1:2
B.反应停止后n(NaClO):n(NaCl):n(NaClO3)可能为1:11:2
C.若反应过程中消耗lmol氯气,则1mol<转移电子<![]() mol
mol
D.溶液中c(Na+)和c(Cl-)之比可能为5:2
【答案】D
【解析】
A. 根据题意,氯气和NaOH反应生成NaCl、NaClO、NaClO3,得出钠原子的物质的量等于氯原子的物质的量,即n(NaOH)=n(Na+)=n(Cl)=![]() n(Cl2),消耗氯气的物质的量与NaOH的物质的量之比为1:2,故A说法正确;
n(Cl2),消耗氯气的物质的量与NaOH的物质的量之比为1:2,故A说法正确;
B. 根据化合价,NaCl为还原产物,NaClO、NaClO3为氧化产物,假设生成11molNaCl,转移电子物质的量为11mol,生成1molNaClO和2molNaClO,转移电子物质的量为(1mol×1+2mol×5)=11mol,得失电子数目守恒,反应停止后n(NaClO):n(NaCl):n(NaClO3)可能为1:11:2,故B说法正确;
C. 假设生成NaCl和NaClO,消耗1molCl2,转移1mol电子,假设生成NaCl和NaClO3,消耗1molCl2,转移电子物质的量为![]() mol,因此生成NaCl、NaClO、NaClO3过程中消耗1molCl2,则1mol<转移电子<
mol,因此生成NaCl、NaClO、NaClO3过程中消耗1molCl2,则1mol<转移电子<![]() mol,故C说法正确;
mol,故C说法正确;
D. 若只发生Cl2+2NaOH=NaCl+NaClO+H2O,n(Na+):n(Cl-)=2:1,若只发生3Cl2+6NaOH=5NaCl+NaClO3+3H2O,n(Na+):n(Cl-)=6:5,该比值的范围是![]() ,5:2不在该范围内,故D说法错误;
,5:2不在该范围内,故D说法错误;
答案:D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量的关系如图所示。
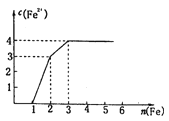
溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1:1:1B.1:3:1C.1:1:4D.3:3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下表是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
结构简式 |
|
|
|
键线式 |
|
|
|
①![]() +H2
+H2![]()
![]()
②![]() +H2
+H2![]()
![]()
③![]() +H2
+H2![]()
![]()
④![]() +KMnO4
+KMnO4![]()
![]() +
+![]() +Mn2+
+Mn2+
回答下列问题:
(1)环烷烃与___________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是______(填名称),判断依据为_________。
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件反应,其化学方程式为(不需注明反应条件)____________。
(4)写出鉴别环丙烷与丙烯的一种方法:试剂___________;现象与结论 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
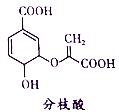
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )

A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家威廉·诺尔斯、柏利·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖。所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物: 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应 B. 与NaOH水溶液共热
C. 在催化剂存在下与氢气作用 D. 与银氨溶液作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二正丁基锡羧酸酯是一种良好的大肠杆菌,枯草杆菌的杀菌剂。合成一种二正丁基锡羧酸酯的方法如图1:

将0.45g的2-苯甲酰基苯甲酸和0.500g的二正丁基氧化锡加入到50mL苯中,搅拌回流分水6小时。水浴蒸出溶剂,残留物经重结晶得到白色针状晶体。
各物质的溶解性表
物质 | 水 | 苯 | 乙醇 |
2-苯甲酰基苯甲酸 | 难溶 | 易溶 | 易溶 |
二正丁基氧化锡 | 难溶 | 易溶 | 易溶 |
正丁基锡羧酸酯 | 难溶 | 易溶 | 易溶 |
回答下列问题:
(1)仪器甲的作用是___,其进水口为___。
(2)实验不使用橡胶塞而使用磨口玻璃插接的原因是___。
(3)分水器(乙)中加蒸馏水至接近支管处,使冷凝管回流的液体中的水冷凝进入分水器,水面上升时可打开分水器活塞放出,有机物因密度小,位于水层上方,从分水器支管回流入烧瓶。本实验选用的分水器的作用是__(填标号)
A.能有效地把水带离反应体系,促进平衡向正反应方向移动
B.能通过观察水面高度不再变化的现象,判断反应结束的时间
C.分离有机溶剂和水
D.主要起到冷凝溶剂的作用
(4)回流后分离出苯的方法是__。
(5)分离出苯后的残留物,要经重结晶提纯,选用的提纯试剂是__(填标号)
A.水 B.乙醇 C.苯
(6)重结晶提纯后的质量为0.670g,计算二正丁基锡羧酸酯的产率约为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com