
【题目】利用下列实验装置能完成相应实验的是
选项 | 装置图 | 实验目的 |
A |
| 收集干燥的HCl |
B |
| 除去CO2中含有的少量HCl |
C |
| 收集H2、NH3、CO2、Cl2、HCl、NO、NO2等气体 |
D |
| 检查装置的气密性 |
A.AB.BC.CD.D
【答案】D
【解析】
A. HCl为酸性气体,能被碱性的干燥剂吸收;
B. CO2和HCl均能与Na2CO3反应;
C. H2、NH3的密度小于空气,Cl2、HCl、NO、NO2等气体的密度大于空气,且其中NO能与空气中的O2发生反应;
D. 用针筒向试管中充入气体,当装置气密性良好时,长导管中会出现水柱。
A. HCl为酸性气体,能被碱性的干燥剂吸收,因此不能用该装置收集干燥的HCl,A项错误;
B. CO2和HCl均能与Na2CO3反应,因此不能用该装置除去CO2中含有的少量HCl,B项错误;
C. H2、NH3的密度小于空气,选择向下排空气法收集,用该装置收集气体时导管应短进长出,Cl2、HCl、NO2等气体的密度大于空气,选择向上排空气法收集,用该装置收集气体时导管应长进短出,NO能与空气中的O2反应,不能用该装置收集,C项错误;
D. 用针筒向试管中充入气体,当装置气密性良好时,长导管中会出现水柱,因此可用该装置检查气密性,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如图所示:
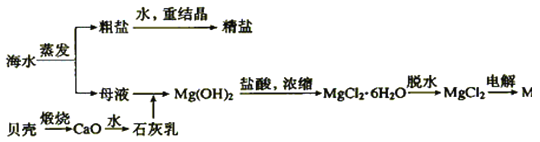
(1)写出下列反应的化学方程式。
①石灰乳与母液反应___;
②Mg(OH)2中加入盐酸的离子方程式:__;
③MgCl2![]() Mg:___。
Mg:___。
(2)在海水提取镁的过程中,没有涉及的化学反应类型__
A.分解反应 B.化合反应 C.复分解反应 D.置换反应 E.氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol L-1HB溶液中逐滴滴入 0.1mol L-1NaOH溶液,所得 PH变化曲线如图所示。下列说法错误的是

A.OA各点溶液均存在:c(B-) >c(Na+)
B.C至 D各点溶液导电能力依次增强
C.点 O时,pH>1
D.点 C时,X约为 10.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,0.1mol·L-1某一元酸(HA)溶液中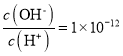 ,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
B.已知:0.1mol·L-1KHC2O4溶液呈酸性,则存在关系:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)>c(H+)>c(OH-)
C.25℃,H2SO3![]() HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
D.0.1mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。
回答下列问题:
(1)基态Ge原子价电子排布图为_______,Ge原子的电子发生跃迁时会吸收或发出不同的光,可用光谱分析仪获得______光谱(填“连续”或 “线状”),鉴定Ge元素的存在。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是______。
②推测 1molGenH2n+2中含有的σ键的数目是_____(用NA表示阿伏加德罗常数值)。
(3)利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中 EMIM+结构如图所示。
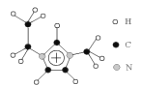
①该物质的晶体类型是_________。
②EMIM+ 离子中组成元素的电负性由小到大的顺序是________。
(4)独立的NH3分子中H-N-H 的键角为 107.3 ,[Zn(NH3)6]2+离子中H-N-H的键角________107.3° ( 填“大于”、“小于”或“等于” )。
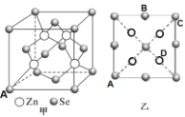
(5)硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是_____;已知晶胞边长为a pm,乙图为甲图的俯视图,A点坐标为( 0,0,0),B点坐标为(![]() ,a,
,a,![]() ) ,则 D点坐标为_______;若该晶胞密度为ρ g·cm-3,则阿伏加德罗常数NA为_______(列出计算式)。
) ,则 D点坐标为_______;若该晶胞密度为ρ g·cm-3,则阿伏加德罗常数NA为_______(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
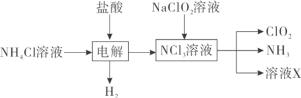
①电解时阳极电极反应式为__________________________。
②除去ClO2中的NH3可选用的试剂是___________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(2)用如图装置可以测定混合气中ClO2的含量:
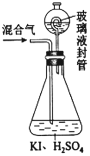
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为______________________。
②玻璃液封装置的作用是______________________。
③V中加入指示剂,滴定至终点的现象是______________________。
④测得混合气中ClO2的质量为______g。
⑤某同学用某部分刻度模糊不清的50mL滴定管进行实验,当滴定管中的液面处于如图所示的刻度处,则管内液体的体积________(填代号)。
a.等于23.60mL b.等于27.60mL c.小于23.60mL d.大于27.60mL
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法,正确的是
A.某溶液加强碱并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液溶质为铵盐
B.将硝酸亚铁样品溶于稀硫酸,滴加硫氰化钾溶液,溶液变为血红色,可推知该样品已经氧化变质
C.往含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干,得到FeCl3固体
D.向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅,证明Na2CO3溶液中存在水解平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是________。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式_________________________
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是_______________(用离子方程式表示) 。
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,回答下列问题:
①配平该反应的离子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O___________
②要检验该反应后的溶液中是否还含有 Fe2+,可选用的试剂为___________
A. 酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图实验装置进行相关实验,能得出相应实验结论的是( )
a | b | c | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa溶液 | 酸性:碳酸>苯酚 | |
B | Br2的苯溶液 | 铁屑 | AgNO3溶液 | 苯和液溴发生取代反应 | |
C | 浓盐酸 | 酸性KMnO4溶液 | 碘化钾溶液 | 氧化性:Cl2>I2 | |
D | 饱和食盐水 | 电石 | 酸性KMnO4溶液 | 乙炔具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com