
【题目】H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1ml,滴定过程中发生的一个反应为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为_________________。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用_________。
a.普通漏斗和滤纸 b.布氏漏斗和滤纸 c.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因_____而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是__________________。
(4)KMnO4标准液滴定H2O2的离子方程式为___________________;当滴定到______________可以认为已达到滴定终点。
(5)该医用消毒剂中H2O2的物质的量浓度为_______________mol·L-1。
(6)②中若用盐酸代替H2SO4,测定结果将___________(填“偏高”“ 偏低”或“无影响”)。
【答案】酸式滴定管(或移液管) c 草酸分解 生成的 Mn2+对反应具有催化作用 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O 滴入一滴KMnO4溶液后,锥形瓶中液体由无色变为浅红色且半分钟内不恢复原色 ![]() 偏高
偏高
【解析】
(1)②中移取10.00mLH2O2待测液具有氧化性,能腐蚀乳胶管,所用主要仪器名称为酸式滴定管(或移液管);(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,KMnO4标准液具有强氧化性,该过滤操作需用不需滤纸的微孔玻璃漏斗,故选C;(3)温度过高可能会因草酸分解而导致KMnO4标准液的标定浓度偏高;开始时反应速率较慢,随后加快,导致速率加快的原因是 生成的 Mn2+对反应具有催化作用;(4)KMnO4标准液滴定H2O2,KMnO4还原成Mn2+,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;当滴定到滴入一滴KMnO4溶液后,锥形瓶中液体由无色变为浅红色且半分钟内不恢复原色可以认为已达到滴定终点。
(5)先求出KMnO4标准液的浓度
5H2C2O4 + 2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5mol 2mol
mg/134g·mol-1 cV1×10-3L
![]()
c=![]() mol·L-1
mol·L-1
该医用消毒剂中H2O2的物质的量浓度为
2MnO4- + 5H2O2+6H+=2Mn2++5O2↑+8H2O
2mol 5mol
cV2×10-3L c2×25×10-3L×10/500
![]()
c2=![]() mol·L-1
mol·L-1
(6)②中若用盐酸代替H2SO4,盐酸也能与标准液反应,测定结果将偏高。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
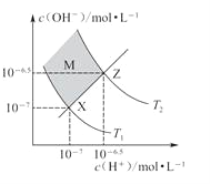
A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业所用的精盐由粗盐提纯,粗盐中含有泥沙等不溶性杂质,以及可溶性杂质:Ca2+,Mg2+,SO42-等,提纯的流程如下图:
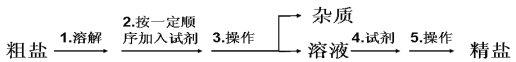
(1)整个流程中所用试剂: ①NaOH溶液、②BaCl2溶液、③Na2CO3溶液、 ④盐酸,下列加入试剂顺序正确的是___________________。
A ①②③④ B ①③②④ C ①②④③ D ②③①④ E ③②①④
除去Mg2+的化学方程式__________________________________________
(2)实验室需配置480mL0.2mol/L的NaCl溶液,用电子天平称取___________g上述精盐,配置时需要的仪器烧杯、玻璃棒外,还需要________________________________。使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是______________(填编号)。
①向容量瓶中转移溶液时不慎将液滴洒在容量瓶外面
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,仰视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.152 | 0.143 | 0.160 | 0.102 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A. 氢化物的沸点为H2T<H2R
B. L+与T2-的核外电子数相等
C. 单质L在空气中燃烧生成的氧化物中,氧元素化合价为-1价
D. M与T形成的二元化合物具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构和化学用语的说法正确的是( )
A. 39 g Na2O2晶体中所含阴、阳离子总数为2NA
B. 1个氮气分子中存在3对共用电子对
C. NaOH和Na2O中所含的化学键类型完全相同
D. AlCl3和MgF2中都含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验二氧化硫中是否混有二氧化碳气体,可采用的方法是( )
A.通过品红溶液
B.先通过氢氧化钠溶液,再通过澄清石灰水
C.通过澄清石灰水
D.先通过酸性高锰酸钾溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应表达正确的是 ( )
A. 1—丙醇与浓氢溴酸反应:CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O
CH3CH2CH2Br + H2O
B. 硬脂酸与乙醇的酯化反应:C17H35COOH + C2H518OH ![]() C17H35COOC2H5 + H218O
C17H35COOC2H5 + H218O
C. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH + OH— ![]() CH2BrCOO— + H2O
CH2BrCOO— + H2O
D. 向丙氨酸钠中加入足量盐酸: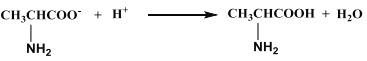
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池正极反应为:
A.O2+4H++4e–=2H2OB.H2 – 2e–=2H+
C.O2+2H2O+4e–=4OH–D.H2 – 2e–+2OH–=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构、元素性质的说法正确的是
A. 非金属元素组成的化合物中只含共价键
B. IA族金属元素是同周期中金属性最强的元素
C. 同种元素的原子均有相同性质的质子数和中子数
D. VIIA族元素的阴离子性还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com