
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
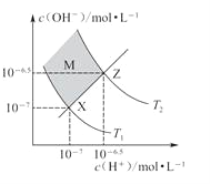
A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A.酸雨湖易发生析氢腐蚀、沙锅存留盐液时易发生吸氧腐蚀
B.当镀锡铁制品的镀层破损时,铁不易被腐蚀
C.铁与电源负极相连可实现电化学保护
D.将钢管与锌管一起堆放时可保护钢管少受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象的描述中正确的是( )
A.钠和镁在氯气中燃烧,都产生白色烟雾
B.铜在氯气中燃烧,生成CuCl2,产生蓝色的烟
C.红热的铁丝在氯气中剧烈燃烧,火星四射
D.氢气在氯气中燃烧产生淡蓝色火焰,在瓶口出现白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求用正确的化学用语回答下列问题:
(1)若116号元素用R表示其元素符号,则其最高价氧化物的化学式__________;
(2)写出含有8个质子、10个中子的原子化学符号_____________;
(3)用电子式表示Na2S的形成过程:_______________________________________;
(4)相同物质的量的D2O和H2O中,中子数之比是 ______________ ;
(5)如果氯化钠是由23Na及37Cl两种原子组成,则0.5mol氯化钠中含有的中子数为_______个。
(6)因为红磷比白磷稳定,所以燃烧相同质量的红磷和白磷,___________(填“白磷”或“红磷”)放出的热量多。
(7)除杂:除去乙烷中乙烯所涉及的化学方程式为________________________________ ;
(8)写出制备硝基苯的化学方程式____________________________________________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,取pH=12的NaOH溶液和氨水各10 mL,分别用蒸馏水冲稀至1 L。关于稀释后的溶液的pH的说法正确的是
A.NaOH溶液的pH小于氨水的pHB.NaOH溶液的pH大于氨水的pH
C.两溶液的pH相等D.无法判别两溶液pH的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:________________________。
②每生成1 mol FeO42-转移________ mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________ mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),原因是________________________________________________________________。
(2)地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的化学方程式为[用Fe和HNO3(稀)反应表示]______________________________________。
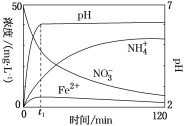
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的二氧化锰与40ml 10mol/L浓盐酸反应产生的氯气,同0.1mol二氧化锰与足量的浓盐酸反应产生的氯气相比
A.前者产生的氯气多 B.一样多
C.后者产生的氯气多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗HIV、抗肿瘤、抗真菌和延缓心血管老化的活性苯并呋喃衍生物(R)的合成路线如下:
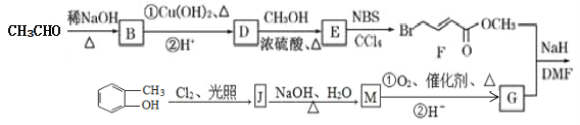

已知: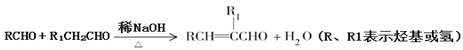
(1)苯并呋喃衍生物(R)的分子式为__________,含有的含氧官能团有________。
(2)E的结构简式为_________________,其核磁共振氢谱峰面积之比为________________。
(3)M→G中反应①的化学方程式为__________________,反应类型是________________。
(4)F与足量氢氧化钠溶液共热反应的化学方程式为_____________________。
(5)化合物G含有苯环的同分异构体有________种,其中苯环上只有一个侧链且能发生银镜反应的结构简式为____________________。
(6)参照上述合成路线,设计以甲苯和乙醛为原料制备苯丙烯酸(![]() )的合成路线____________。
)的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1ml,滴定过程中发生的一个反应为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为_________________。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用_________。
a.普通漏斗和滤纸 b.布氏漏斗和滤纸 c.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因_____而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是__________________。
(4)KMnO4标准液滴定H2O2的离子方程式为___________________;当滴定到______________可以认为已达到滴定终点。
(5)该医用消毒剂中H2O2的物质的量浓度为_______________mol·L-1。
(6)②中若用盐酸代替H2SO4,测定结果将___________(填“偏高”“ 偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com