
【题目】按要求用正确的化学用语回答下列问题:
(1)若116号元素用R表示其元素符号,则其最高价氧化物的化学式__________;
(2)写出含有8个质子、10个中子的原子化学符号_____________;
(3)用电子式表示Na2S的形成过程:_______________________________________;
(4)相同物质的量的D2O和H2O中,中子数之比是 ______________ ;
(5)如果氯化钠是由23Na及37Cl两种原子组成,则0.5mol氯化钠中含有的中子数为_______个。
(6)因为红磷比白磷稳定,所以燃烧相同质量的红磷和白磷,___________(填“白磷”或“红磷”)放出的热量多。
(7)除杂:除去乙烷中乙烯所涉及的化学方程式为________________________________ ;
(8)写出制备硝基苯的化学方程式____________________________________________ ;
【答案】RO3 ![]()
![]() 5:4 16NA 白磷 Br2+CH2=CH2→CH2Br-CH2Br
5:4 16NA 白磷 Br2+CH2=CH2→CH2Br-CH2Br ![]() +HNO3
+HNO3![]() +H2O
+H2O
【解析】
(1)先确定116号元素的原子结构特点,然后根据其最外层电子数等于其最高化合价数确定其氧化物的化学式;
(2)原子在表示时,原子符号左下角为质子数,左上角为质量数;
(3) Na2S是离子化合物,Na+与S2-之间通过离子键结合;
(4)根据H原子核内无中子,D原子核内有1个中子,O原子核内有8个中子分析判断;
(5) 23Na及37Cl含有的中子数分别是12、20,则1mol 23Na 37Cl含有的中子数为32mol,根据![]() 计算所含中子数目;
计算所含中子数目;
(6)反应物含有的能量越低,物质的稳定性就越强;
(7)乙烯与Br2发生加成反应产生液态有机物,而乙烷是气体。可以达到除杂的目的;
(8)在实验室用苯与浓硝酸、浓硫酸的混合物加热发生反应制取硝基苯。
(1)116号元素处于第七周期第VIA族,原子最外层有6个电子,所以最高化合价为+6价,由于O为-2价,根据化合物中元素正负化合价代数和等于0,可知:若116号元素用R表示其元素符号,则其最高价氧化物的化学式为RO3;
(2)含有8个质子的元素为O元素,由于该原子含有10个中子,则质量数为18,所以可表示为:![]() ;
;
(3)Na2S是离子化合物,Na原子失去最外层电子形成Na+,S原子获得2个电子形成S2-,Na+与S2-之间通过离子键结合,所以用电子式表示为:![]() ;
;
(4) H原子核内无中子,D原子核内有1个中子,O原子核内有8个中子,一个D2O分子中有10个中子,1个H2O分子中有8个中子,则等物质的量的D2O和H2O所含的中子数的比为10:8=5:4;
(5)23Na含有12个中子,37Cl含有20个中子,则1mol 23Na 37Cl含有的中子数为32mol,则0.5mol 23Na 37Cl含有的中子数为0.5mol ×32=16mol,含有的中子数为N=16mol×NA=16NA;
(6)红磷与白磷等质量,完全燃烧,反应产生五氧化二磷的质量相等;由于红磷比白磷稳定,说明红磷的能量低,白磷的能量高,则等质量的红磷与白磷燃烧时 含有能量高的白磷放出的热量多;
(7)除去乙烷中混有的乙烯杂质,可以将混合气体通过盛有溴水的洗气瓶,乙烯与溴水发生反应:Br2+CH2=CH2→CH2Br-CH2Br,反应产生的CH2Br-CH2Br是液态物质,而乙烷是气体,从而达到除杂净化的目的;
(8)在实验室用苯与浓硝酸、浓硫酸混合加热发生取代反应制取硝基苯,同时产生水,反应的化学方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式___________________________________________。
(2)装置C中的试剂是______________;装置F的作用是_____________________________;
装置E中的h瓶需要冷却的理由是_____________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式:______________。
②滴定前是否要滴加指示剂?_____(填“是”或“否”),请说明理由___________________。
③滴定前检验Fe3+是否被完全还原的实验操作是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、环境密切相关。如图为雾霾的主要成分示意图。下列说法不正确的是

A. 雾属于胶体,能产生丁达尔效应
B. SO2 和 N xOy 都属于酸性氧化物
C. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
D. 重金属离子可导致蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用铁与水蒸气反应后的固体物质(含具有磁性的固体生成物M)进行如下实验:

(1)步骤Ⅱ中,试剂1的化学式是____________________。
(2)步骤Ⅲ中,溶液红色加深的原因是________________。(填离子方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
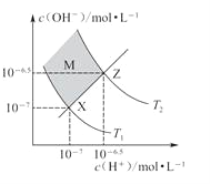
A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.152 | 0.143 | 0.160 | 0.102 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A. 氢化物的沸点为H2T<H2R
B. L+与T2-的核外电子数相等
C. 单质L在空气中燃烧生成的氧化物中,氧元素化合价为-1价
D. M与T形成的二元化合物具有两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com