
【题目】一定条件下,在水溶液中1molCl-,ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )

A.e是ClO3-
B.a,b,c,d,e中c最稳定
C.b→a+c反应的活化能为60kJmol-1
D.b→a+d反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H= -116kJmol-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】严重的雾霾天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。
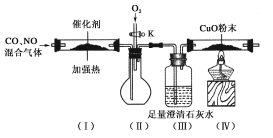
(1)装置(Ⅲ)的主要作用为________________________。
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是___________________。
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后补充____________。
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为________。Na2CO3溶液的物质的量浓度为________mol·L-1(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-=FeO![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数NA说法错误的是( )
A.22 g 2H218O中含有的质子数为10NA
B.电解58.5 g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠
C.1.00 mol NaCl中,所有Na+的最外层电子总数为10NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是提纯大理石(主要杂质是氧化铁)的流程图:

按要求回答下列问题:
(1)在工业生产中,将块状大理石磨成粉末,并在反应池中安装搅拌机。目的是_______________。
(2)操作Ⅱ中A物质最好应选择_______________(填化学式),在该过程中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______________________________。
(3)检验Fe3+已完全生成Fe(OH)3沉淀的方法是_______________。
(4)由滤液B得到晶体B,操作过程包括_______________(填操作名称)、冷却结晶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应3A![]() 2B+D在四种不同条件下进行,B、D的起始浓度为0.反应物A的浓度 c 随时间 t 的变化情况如下表:
2B+D在四种不同条件下进行,B、D的起始浓度为0.反应物A的浓度 c 随时间 t 的变化情况如下表:
实验 序号 | t/min C/molL﹣1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10min~20min 内平均速率为 mol/(Lmin)
(2)在实验2中,A的初始浓度 C2为 mol/L,可推测实验2中还隐含的条件是 。
(3)设实验 3 的反应速率为v3,实验1的反应速率为v1,则v3 v1(填<、>或=),且C3 2.0mol/L (填<、>或=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.依据铝热反应原理,能发生反应:2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
B.在加入铝粉能放出氢气的溶液中:K+、NH4+、CH2COO-、Cl-一定能够大量共存
C.铁片放入过量的稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.氯化铝溶液中加入过量氨水反应实质是:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 非极性键可能存在单质中,也可能存在化合物中
B. 含有离子键的化合物不可能含有非极性键
C. 盐酸中含有H+和Cl-,故HCl为离子化合物
D. 含有共价键的化合物不可能是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
用已知浓度的HCl溶液测定未知浓度的氨水,选用的指示剂_____________
(2)取体积相同的、物质的量浓度相同的两分NaOH溶液,把其中的一份放空气中一段时间后。用已知浓度的硫酸中和上述这两份溶液,若中和第一份(放在空气中一段时间)所消耗硫酸溶液体积为V1,另一份消耗硫酸溶液体积为V2,
①若以甲基橙为指示剂时,V1和V2的关系是_ ___
②若以酚酞为指示剂时,V1和V2的关系是__ ____
(3)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用 0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
①根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
②达到滴定终点的标志是_______________
③以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com