
����Ŀ�������������������ܺͽ����ܵ�ԭ�ϡ�һ�����ú��ܷ���(��Ҫ�ɷ�ΪCo2O3,������Fe2O3��Al2O3��CaO��MgO��̼���л����)��ȡCoC2O4�Ĺ���������ͼ
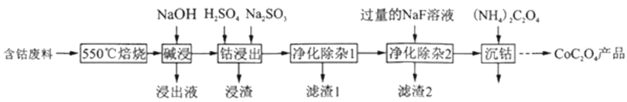
(1)��550����������Ŀ����___��
(2)������Һ������Ҫ�ɷ���___��
(3)���ܽ�����������Co3+ת��ΪCo2+����Ӧ�����ӷ���ʽΪ___��
(4)����������1��������,����4050������H2O2,��������___(�����ӷ���ʽ��ʾ);��������8085��,����Na2CO3��Һ����pH��4.5��������1����Ҫ�ɷֵ���___.
(5)����������2���ɽ��ơ�þ����ת��Ϊ�������˳�ȥ,��������Һ��c(Ca2+)=1.0��l05mol/L,����Һ��c(Mg2+)Ϊ___[��֪Ksp(MgF2)=7.35��1011��Ksp(CaF2)=1.05��1010.]
(6)Ϊ�ⶨ�Ƶ���Ʒ�Ĵ���,�ֳ�ȡ1.00g��Ʒ,�������ʵ��Լ�ת��,�õ������[(NH4)2C2O4]��Һ,���ù���ϡ�����ữ,��0.1000mol/LKMnO4��Һ�ζ�,�ﵽ�ζ��յ�ʱ,����ȥKMnO4��Һ26.00mL�����������Ʒ�Ĵ���Ϊ___.(������λС��)
���𰸡���ȥ̼���л��� NaAlO2 2Co3++![]() +H2O=2Co2++
+H2O=2Co2++![]() +2H+ 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3 7.0��10-6mol/L 95.55%��
+2H+ 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3 7.0��10-6mol/L 95.55%��
��������
�������̷�����֪�����ú��ܷ���(��Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��CaO��MgO��̼���л����)��ȡCoC2O4����Ҫ��̼���л�����550�����ճ�ȥ������NaOH��Al2O3�ܽ�ת��ΪNaAlO2�������Һ�����û�ԭ��Na2SO3��Co3+��ԭΪCo2+��ͬʱҲ�ὫFe3+��ԭΪFe2+��������������1�������У��������������ͬʱ����pH����Fe2+ת��ΪFe3+������ת��ΪFe(OH)3������Ȼ����������NaF��Һ����Mg2+��Ca2+ת��ΪMgF2��CaF2������ȥ��������(NH4)2C2O4��Һ����Co2+ת��ΪCoC2O4���ݴ˷������
(1)̼���л�����п�ȼ�ԣ����ܷ����е�̼���л�����550������ʱ�������ɶ�����̼�ȱ���ȥ���ʴ�Ϊ����ȥ̼���л��
(2)�����������У�ֻ��Al2O3����NaOH��Һ��������ӦAl2O3+2NaOH��2NaAlO2+H2O������������Һ������Ҫ�ɷ���NaAlO2���ʴ�Ϊ��NaAlO2��
(3)���ܽ�����������Co3+ת��ΪCo2+��ͬʱNa2SO3ת��ΪNa2SO4����Ӧ�����ӷ���ʽΪ2Co3++SO32-+H2O=2Co2++SO42-+2H+����Ϊ��2Co3++SO32-+H2O=2Co2++SO42-+2H+��
(4)����������1�������У��������������ͬʱ����pH����Fe2+ת��ΪFe3+������ת��ΪFe(OH)3���������ԣ���40��50������H2O2��Һ����Ŀ����2Fe2++2H++H2O2=2Fe3++2H2O����������80��85��������Na2CO3��Һ����pH��5��ʹ������ת��Ϊ������������������������I������Ҫ�ɷ���Fe(OH)3����Ϊ��2Fe2++2H++H2O2=2Fe3++2H2O��Fe(OH)3��
(5)����Ksp(CaF2) =1.05��10-10����������Һ��c(Ca2+)=1.0��l0-5mol /L����c(F-)=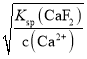 =
=![]() mol /L����c(Mg2+)=
mol /L����c(Mg2+)=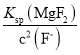 =
=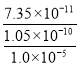 =7.0��10-6mol/L���ʴ�Ϊ7.0��10-6mol/L��
=7.0��10-6mol/L���ʴ�Ϊ7.0��10-6mol/L��
(6)������ܵ�����Ϊx�����ݷ���ʽ��5H2C2O4+2MnO4-+6H+=2Mn2++10CO2��+8H2O��������غ�ɵã�5CoC2O4~5(NH4)2C2O4~5H2C2O4~2MnO4-����n(CoC2O4)=n(H2C2O4)=![]() ��0.1000mol/L��0.026L=0.0065mol���ò�Ʒ�Ĵ���Ϊ
��0.1000mol/L��0.026L=0.0065mol���ò�Ʒ�Ĵ���Ϊ![]() =95.55%����Ϊ��95.55%��
=95.55%������95.55%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�����������ʵ��װ�á�ʵ��ʱ���ֶϿ�K2���պ�K1�������������ݲ�����һ��ʱ��Ͽ�K1���պ�K2�����ֵ�����ָ��ƫת�������й�������ȷ����

A. �Ͽ�K2���պ�K1ʱ���ܷ�Ӧ�����ӷ���ʽΪ��2H++2Cl��![]() Cl2��+H2��
Cl2��+H2��
B. �Ͽ�K2���պ�K1ʱ��ʯī�缫������Һ���
C. �Ͽ�K1���պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦΪ��Cl2+2e����2Cl��
D. �Ͽ�K1���պ�K2ʱ��ʯī�缫������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������š�ϵ�л���õ�ȼ����Һ̬��ƫ������(C2H8N2)����������Һ̬��N2O4����֪��֪1.5gƫ��������ȫȼ������N2��CO2��Һ̬H2O�ų�����50kJ����������˵������ȷ����
A. ȼ���ڻ����������ȼ���ǽ���ѧ����Ҫת��Ϊ���ܺͻ�е��
B. Һ̬N2O4����ʱ���ۼ�û���ƻ�
C. �����֪C2H8N2��ȼ����Ϊ50kJ/mol
D. ƫ��������N2O4��ȼ��ʱ�Ļ�ѧ����ʽΪ��C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������Ͳ��ȡ50 mL 0.50 mol��L��1���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50 mL 0.55 mol��L��1 NaOH��Һ������ͬһ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȡ��ش��������⣺

��1����ͼ��������δ������������______��__________��
��2��Ϊʲô����NaOH��ҺҪ�Թ���_________________��
��3������NaOH��Һ����ȷ������_______________________��
��4���ֽ�һ������ϡ����������Һ��ϡ����������Һ��ϡ��ˮ�ֱ��1 L 1 mol��L��1��ϡ����ǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�Ϊ��H1����H2����H3������H1����H2����H3�Ĵ�С��ϵΪ______��
��5���������������������Һ���ܶȶ���1 g��cm��3����֪�кͷ�Ӧ��������Һ�ı�����c��4.18 J��g��1������1��Ϊ�˼����к��ȣ�ijѧ��ʵ���¼�������£�
ʵ�� ��� | ��ʼ�¶�t1/ �� | ��ֹ�¶�t2/ �� | |
���� | ����������Һ | �����Һ | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к�����H��______(�������һλС��)��
��6��____(������������������)��Ba(OH)2��Һ�������������������Һ�����ᣬ������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����25�桢101kPa�£�һ����������ˮ�Ҵ���ȫȼ��ʱ�ų�����Q kJ����ȼ�����ɵ�CO2�ù�������ʯ��ˮ���տɵ�100gCaCO3���������Ҵ�ȼ�յ��Ȼ�ѧ����ʽΪ___��
��2����֪�����Ȼ�ѧ����ʽ
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H1= -25kJ��mol-1 ��
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ��H2= -47kJ��mol-1 ��
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ��H3= +19kJ��mol-1 ��д��FeO(s)��CO��ԭ��Fe��CO2���Ȼ�ѧ����ʽ____��
��3��������H2SO4��Һ�м���100mL 0.4mol��L-1Ba(OH)2��Һ���ų���������5.12kJ�����������Ba(OH)2��Һ�м���100mL 0.4mol��L-1����ʱ���ų�������Ϊ2.2kJ����Na2SO4��Һ��BaCl2��Һ��Ӧ���Ȼ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ,��1.0L c mol��L-1 CH3COOH��Һ��0.1mol NaOH�����ϣ�ʹ֮��ַ�Ӧ��Ȼ����û����Һ��ͨ��HCl��������NaOH����(����������¶ȱ仯)����ҺpH��ͨ��(�����)���ʵ����ʵ����ı仯��ͼ��ʾ�����������������( )
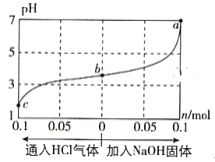
A. ˮ�ĵ���̶ȣ�a>b>c
B. c���Ӧ�Ļ����Һ�У�c(CH3COOH)>c(Na+)>c(OH-)
C. a���Ӧ�Ļ����Һ�У�c(Na+)=c(CH3COO-)
D. ���¶��£�CH3COOH�ĵ���ƽ�ⳣ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ�������У���ȷ����(����)
A. ��20.0gNaOH��ϡ��Һ��������ϡ������ȫ�кͣ��ų�28.7kJ�����������ʾ�к��ȵ��Ȼ�ѧ����ʽΪ2NaOH(aq)��H2SO4(aq)��Na2SO4(aq)��2H2O(l) ��H����114.8kJ��mol-1
B. ��֪�Ȼ�ѧ����ʽ��SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����98.32kJ��mol-1���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ196.64kJ
SO3(g) ��H����98.32kJ��mol-1���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ196.64kJ
C. ��֪2H2(g)��O2(g)��2H2O(g) ��H����483.6kJ��mol-1����H2��ȼ����Ϊ241.8kJ��mol-1
D. ��֪ʯīת��Ϊ���ʯΪ���ȣ���ôʯī�Ƚ��ʯ�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��1 mol/L��HClO2�ͣ�1 mol/L��HMnO4��������Һ����ʼʱ�������ΪVo���ֱ�������Һ�м�ˮ����ϡ�ͣ�ϡ�ͺ���Һ���ΪV������������ͼ��ʾ������˵����ȷ���� ( )

A. ϡ��ǰ�ֱ���1mol��L-1��NaOH��Һ�кͣ����ĵ�NaOH��Һ�����HMnO4��HClO2
B. ��ϡ����pH��Ϊ3ʱ����Һ��c(ClO2-)��c(MnO4-��
C. ��0��pH��5ʱ��HMnO4��Һ���㣬pH= ![]()
D. �����£�Ũ�Ⱦ�Ϊ0.1mol��L-1��NaClO2��NaMnO4��Һ��pH: NaMnO4��NaClO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£������й�������ȷ����
A. ��0.1 mol��L1 Na2CO3��Һ��ͨ������CO2�����c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. �����£�pH=6��NaHSO3��Һ�У�c(![]() )c(H2SO3)=9.9��107 mol��L1
)c(H2SO3)=9.9��107 mol��L1
C. �����ʵ���Ũ�ȡ��������Na2CO3��NaHCO3��ϣ�![]() <
<![]()
D. 0.1 mol��L1 Na2C2O4��Һ��0.1 mol��L1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com