
【题目】下列延长食品保质期的方法中,其原理与其它几种不同的是
A. 加食盐腌制 B. 抽真空 C. 充氮气 D. 使用吸氧剂
科目:高中化学 来源: 题型:
【题目】已知X为地壳中含量最高的元素,则X在元素周期表中的位置是
A. 第一周期ⅠA族 B. 第二周期ⅣA族
C. 第二周期ⅥA族 D. 第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,试管中集满了干燥的氯气,胶头滴管中装有供反应的足量浓氨水,滴入浓氨水,开始时试管内发生如下氧化还原反应:NH3+Cl2 →N2+HCl并产生红光和白烟,请根据以上反应现象回答下列问题:

(1)标志反应全部完成的现象是________________________。
(2)反应完成后,将试管浸入水中并倒立着试管,取下滴管,有水进入试管。在室温时,进入试管内的水约占试管容积的_________。
(3)反应中生成的白烟是:_____________________________。
(4)写出试管中反应的化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品:

(1)“酸浸”时加快反应速率的方法除了增加硫酸的浓度和加热外,还有___________________。(写出一种)
(2)在加NaOH调节溶液的pH时约为5,如果pH过大,可能导致滤渣1中 ___________________(填化学式)的含量减少。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8(过二硫酸氨)溶液,加热,Mn2+被氧化为MnO4-,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,平均消耗(NH4)2Fe(SO4)2标准溶液的体积为V mL。
①Mn2+与(NH4)2S2O8反应的离子方程式为___________________________________________。
②用含a、b、V的代数式表示“沉锰”前溶液中c(Mn2+)=_______________。
(4)①写出“沉锰”时的离子方程式:___________________________________________。
②在其他条件相同时,NH4HCO3的初始浓度越大,锰元素回收率越高,请从沉淀溶解平衡的角度解释其原因___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 碳水化合物就是碳的化合物B. 符合通式Cm(H2O)n的有机物都是糖类
C. 糖类就是有甜味的化合物D. 糖类物质完全燃烧都能产生二氧化碳和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对平衡体系H2(g)+I2(g)![]() 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
B. 用稀盐酸洗涤AgCl沉淀比用等体积的蒸馏水洗涤损失的AgCl少
C. 实验室可用排饱和食盐水的方法收集氯气
D. 工业合成三氧化硫的过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应 ⑦酯化反应
A. ②⑤⑥B. ②④⑤C. 只有⑥D. 只有⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI===2KCl+I2。请回答下列问题:
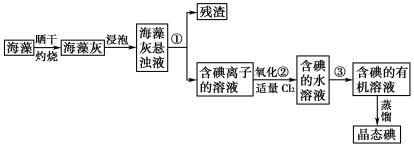
(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为紫红色溶液)。

(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①________________________________;
②________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是
A.0.3 mol·L1的Na2SO4溶液中含有Na+和![]() 的总物质的量为0.9 mol
的总物质的量为0.9 mol
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和![]() 的物质的量相等,则K+和Cl的物质的量浓度一定相等
的物质的量相等,则K+和Cl的物质的量浓度一定相等
D.10 ℃时,0.35 mol·L1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com