
【题目】下列各组物质气化或熔化时,所克服的微粒间作用力完全相同的是 ( )
A.碘的升华和干冰气化B.二氧化硅熔化和干冰气化
C.苯气化和硝酸钾熔化D.食盐熔化和冰融化
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知铜的配合物A(结构如图)。请回答下列问题:
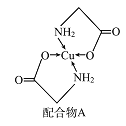


(1)Cu的简化电子排布式为______________ 。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_______________。其中氮原子的杂化轨道类型为________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比
是__________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_______。
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H CO的键角___________(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在右图中表示出来___________。
(5)立方氮化硼(如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,上图(右)立方氮化硼的晶胞中,B原子的坐标参数分别有:
![]() 等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下11.2 L的甲烷气体含有甲烷分子数为0.5 NA个
B. 14g乙烯和丙烯的混合物中总原子数为3 NA个
C. 0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1 NA个
D. 5.6 g铁与足量的稀硫酸反应失去电子数为0.3 NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:A、金刚石和石墨 B、C2H6和C5H12 C、12C和14C D、正丁烷和异戊烷 E、葡萄糖和果糖 F、红磷和白磷G、NH4CNO与尿素(CO(NH2)2) H、35Cl和37Cl I、 J、
J、
(1)属于同分异构体的是 ____________(填序号,下同);
(2)属于同素异形体的是__________(3)属于同系物的是___________
(4)属于同位素的是______________(5)属于同一种物质的是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素和氢元素的质量比都是12:1的三种烃A、B、C。常温下,A呈气态,B和C呈液态,A、B、C相对分子质量比为1:3:4。A和C既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色;B既不能使溴的四氯化碳溶液褪色,又不能使酸性KMnO4溶液褪色。A、C都能发生加聚反应,A的加聚产物具有导电性,C的加聚产物则是使用广泛的塑料。
(1)写出A、B、C的分子式A:______________ B:________________C:_________________
(2)写出A、C分别加聚所得产物的结构简式A:___________________________ B:________________________
(3)写出C与溴的四氯化碳溶液反应的方程式_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化氢极易溶于水,标准状况下,1体积的水可以溶解500体积的氯化氢(HCl)气体,氯化氢的水溶液即为盐酸。
实验室现有质量分数为36.5%、密度为1.19gcm﹣3的浓盐酸,若用该浓盐酸配制0.4molL﹣1的稀盐酸220mL,试回答下列问题:
(1)配制该稀盐酸时,应选用的容量瓶的容积为(______).
A. 100mL B. 220mL C. 250mL D. 500mL
(2)计算需要____mL的浓盐酸,
(3)在量取浓盐酸后,进行了下列操作:
①待稀释盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中.
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛蒸馏水的烧杯中注入盐酸,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)_____________。
(4)在下述配制过程中,配制的稀盐酸浓度将会偏高的是_________________;使浓度会偏低的是 _________________________。(填序号)
①未转移溶液前容量瓶中有少量的蒸馏水
②量取浓盐酸时俯视刻度线
③量取浓盐酸后用蒸馏水洗涤量筒
④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
⑤定容时俯视刻度线
(5)在标准状况下,用一支收集满HCl气体的试管倒立在水槽中,水倒吸当充满试管时用塞子堵住试管口竖立(假设溶液不泄漏),则该溶液的溶质的物质的量浓度为_________________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:①CO的结构式为C![]() O;②298K时相关化学键的键能数据如下表:
O;②298K时相关化学键的键能数据如下表:
化学键 | H—H | O—H | C—H | C |
E/(KJ·mol-1) | 436 | 465 | 413 | 1076 |
则反应 CO(g)+3H2(g)![]() CH4(g)+H2O(g)的△H的值为
CH4(g)+H2O(g)的△H的值为
A. -198kJ·mol-1 B. +267 kJ·mol-1 C. -298 kJ·mol-1 D. +634 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知:①A核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1 mol D可与1 mol NaOH或2 mol Na反应。
回答下列问题:
(1)A生成C的化学方程式为____________________________。
(2)C的官能团名称为____________。
(3)D的结构简式为_________________。
(4)由E生成F的反应类型为____________。
(5)L是D的同分异构体,可与FeCl3溶液发生显色反应,1 mol的L可与1 mol的Na2CO3反应,L核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1,L的结构简式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com