
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 1.8g的NH4+离子中含有的电子数为0.1NA
C. 常温常压下,48gO3含有的氧原子数为3NA
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】30mL浓度为0.05molL-1Na2SO3溶液恰好与25mL浓度为0.02molL-1的K2X2O6溶液完全反应,已知Na2SO3可被K2X2O6氧化为Na2SO4,则元素X在还原产物中的化合价为下列的( )
A.+5价B.+4价C.+3价D.+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铷的叙述中正确的是 ( )
A. 氢氧化铷是强碱 B. 在钠、钾、铷三种单质中,铷的熔点最高
C. 硝酸铷是共价化合物 D. 它位于周期表的第四周期、第ⅠA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定的
①分子的直径 ②气体数目多少 ③分子间的距离 ④分子的相对分子质量
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护臭氧层,可采取的有效措施是( )
A. 减少二氧化硫的排放量 B. 减少含铅废气的排放量
C. 减少氟氯烃的排放量 D. 减少二氧化碳的排放量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市环境中的大气污染物主要是
A、 O2、Cl2、HCl 、酸雨
B、 SO2、NO2、CO、烟尘
C、 NH3、CO、CO2、雾
D、 HCl、SO2、N2、粉尘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
Ⅰ.(1)同浓度的CH3COO-、HCO、CO![]() 、HC2O4- 、ClO-、S2-结合H+的能力最弱的____________。
、HC2O4- 、ClO-、S2-结合H+的能力最弱的____________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的
是________(填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D. ![]()
若该溶液升高温度,上述4种表达式的数据增大的是_________________。
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH 变化如图所示,则稀释后,醋酸溶液中由水电离出来的c(H+)_______(填“大于”、“等于”或“小于”)HX 溶液中由水电离出来的c(H+)。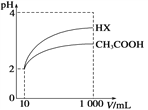
Ⅱ.(1)下列化学方程式可能正确的是______________。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)写出过量CO2通入Na2S溶液中的离子方程式______________________________________。
(3)将过量的氯气通入到少量的碳酸钠溶液中_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是( )
A. pH=7的溶液 B. c(H+)=1.0×10-7mol·L-1的溶液
C. c(H+)=c(OH-)的溶液 D. pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E为短周期元素,A,B,C在周期表中所处的位置如图所示,A,C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A,E可形成AE3型分子,分子中只存在极性键. ![]()
(1)B元素在元素周期表中的位置是 .
(2)C的离子结构示意图为 , 用电子式表示AE3的形成过程: .
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有 .
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com