
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+nD(g),开始时A为4mol,B为6mol;5min后达到化学平衡,此时C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(Lmin).
(1)5min末B的物质的量浓度为
(2)前5min内化学反应速率v(A)为
(3)化学方程式中n值为
(4)该反应在此温度下的平衡常数K=(填数值).
【答案】
(1)2mol/L
(2)0.1mol/(L?min)
(3)2
(4)0.5625
【解析】解:5min后达到化学平衡,此时C的物质的量为3mol,v(C)= ![]() =0.3mol/(Lmin),用D表示的化学反应速率v(D)为0.2mol/(Lmin),由速率之比等于化学计量数之比可知,
=0.3mol/(Lmin),用D表示的化学反应速率v(D)为0.2mol/(Lmin),由速率之比等于化学计量数之比可知, ![]() ,解得n=2,则
,解得n=2,则
A(g)+ | 2B(g) | 3C(g)+ | 2D(g) | |
起始 | 4 | 6 | 0 | 0 |
转化 | 1 | 2 | 3 | 2 |
平衡 | 3 | 4 | 3 | 2 |
;(1)5min末B的物质的量浓度为 ![]() =2mol/L,所以答案是:2mol/L;(2)前5min内化学反应速率v(A)为
=2mol/L,所以答案是:2mol/L;(2)前5min内化学反应速率v(A)为 ![]() =0.1mol/(Lmin),所以答案是:0.1mol/(Lmin);(3)由上述分析可知化学方程式中n值为2,所以答案是:2;(4)A、B、C、D的平衡浓度分别为1.5mol/L、2mol/L、1.5mol/L、1mol/L,该反应在此温度下的平衡常数K=
=0.1mol/(Lmin),所以答案是:0.1mol/(Lmin);(3)由上述分析可知化学方程式中n值为2,所以答案是:2;(4)A、B、C、D的平衡浓度分别为1.5mol/L、2mol/L、1.5mol/L、1mol/L,该反应在此温度下的平衡常数K= ![]() =0.5625,所以答案是:0.5625.
=0.5625,所以答案是:0.5625.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的工业用盐,某同学针对亚硝酸钠设计了如下实验:(已知:Na2O2+2NO=2NaNO2;Na2O2+2NO2=2NaNO3)

(1)该同学用以上仪器制备NaNO2,则装置的连接顺序为A→___→___→___→___→E。_________(填序号,可重复)
(2)仪器a的名称为______________。
(3)NO在E中可被氧化成NO3-,写出反应的离子方程式_________________________。
(4)比色法测定样品中的NaNO2含量:
①在5个有编号的带刻度试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2的浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
试管编号 | a | b | c | d | e |
NaNO2含量/(mg.L-1) | 0 | 20 | 40 | 60 | 80 |
②称量0.10g制得的样品,溶于水配成500mL溶液,取5mL 待测液,加入1mLM溶液,再加蒸馏水至10mL 并振荡,与标准比色阶比较;
③比色的结果是: 待测液的颜色与d 组标准色阶相同,则样品中NaNO2的质量分数为_______。
(5)滴定法测定样品中的NaNO2含量:
①称量0.5000g制得的样品,溶于水配成500mL溶液,取25.00mL待测液于锥形瓶中,加入s mL KI 酸性溶液(足量),发生反应2NO2-+2I-+4H+=2NO↑+I2+2H2O;
②滴入2~3 滴_____作指示剂,用0.0100mol/LNa2S2O3溶液进行滴定,当看到______现象时,即为痛定终点(已知,2 Na2S2O3+ I2=Na2S4O6+2NaI);
③重复实验后,平均消耗Na2S2O3溶液的体积为20.50mL,则样品中NaNO2的质量分数为____(保留3 位有效数字)。
④下列操作会导致测定结果偏高的是______(填序号)。
A.滴定过程中向锥形瓶中加少量水
B.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
C.观察读数时,滴定前仰视,滴定后俯视
D.滴定时摇瓶幅度过大标准溶液滴到瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某烷烃的键线式为![]() ,
,
①该烷烃分子式为_____。
②若该烷烃是由烯烃和 1molH2加成得到的,则原烯烃的结构有_____种。
③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有______种。(此小题不包括立体异构)
(2)沧州铁狮酒的主要成分是我们学习的有机物——乙醇,请写出该有机物官能团的名称______,该官能团的电子式______。我们还学习了与乙醇结构相似的一系列有机物如:
A.CH3OH B.(CH3)3CCH2OH C.(CH3)3COH D.(CH3)2CHOH等有机物(填字母)
①能氧化成醛的是_______ ②不能发生消去反应形成烯的是_________③能氧化成酮的是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式均为C5H10O2的两种有机物的结构简式如右图所示:
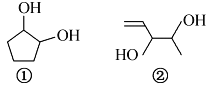
下列说法正确的是
A. 二者都能使Br2的CCl4溶液褪色
B. ①②分子中所有原子均可能处于同一平面
C. 等质量的①和②分别与足量钠反应生成等质量的H2
D. 与其互为同分异构体的酯有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,分别改变相同物质的量浓度的H2CO3和氨水的pH,H2CO3、HCO3-、CO32-物质的量分数 (δ)及NH3·H2O、NH4+的物质的量分数(δ)如下图所示(不考虑溶液中的CO2和NH3分子):

[已知δ=![]() 、δ=
、δ=![]() ]
]
下列说法正确的是
A. NH4HCO3溶液显酸性
B. pH=5时,c(HCO3-)>c(H2CO3) >c(CO32-)
C. lgK1(H2CO3)=6.38
D. HCO3-+ NH3·H2O=NH4++CO32-+H2O的lgK=-0.95
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)在25℃时,若100体积的某强酸溶液与1体积的某强碱溶液混合溶液中性,则混和前强酸pH1和强碱pH2应该满足的关系是pH1+pH2=
(2)某温度(t℃)时,水的离子积Kw=10﹣12 , 则该温度(填大于、小于或等于)25℃.将此温度下,将pH=2的硫酸溶液V1L与pH=11的氢氧化钠溶液V2L混合: ①若所得混合液为中性,则V1:V2= .
②若所得混合液的pH=10,则V1:V2= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应的是( )
A.CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
B.Na2O+H2O=2NaOH
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑
D.4HNO3(浓) ![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个蛋白质分子由四条肽链组成,364个氨基酸形成,则这个蛋白质分子含有的-COOH和-NH2 数目分别为 ( )
A. 366、366 B. 362、362 C. 4、 4 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为2 mol·L-1·s-1,则此段时间内用B的浓度变化表示的化学反应速率为( )。
A.5 mol·L-1·s-1 B.6 mol·L-1·s-1 C.2 mol·L-1·s-1 D.3 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com