
【题目】一个蛋白质分子由四条肽链组成,364个氨基酸形成,则这个蛋白质分子含有的-COOH和-NH2 数目分别为 ( )
A. 366、366 B. 362、362 C. 4、 4 D. 无法判断
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+nD(g),开始时A为4mol,B为6mol;5min后达到化学平衡,此时C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(Lmin).
(1)5min末B的物质的量浓度为
(2)前5min内化学反应速率v(A)为
(3)化学方程式中n值为
(4)该反应在此温度下的平衡常数K=(填数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校合作学习小组的同学设计实验验证Na2SO4与焦炭高温加热后的产物。回答下列问题。
(1)Na2SO4与焦炭反应的实验装置如下图所示:
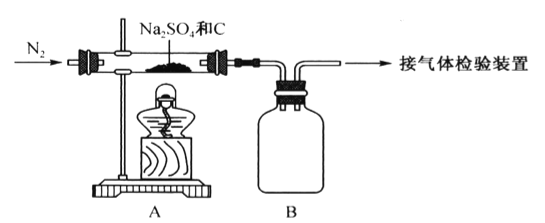
①先通入N2,然后加热,直至反应结束,整个过程中N2的作用是__________________________。
②装置B的作用是___________。
(2)该同学认为气体产物中可能含有CO2、CO 及SO2,并进行验证,选用上述实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
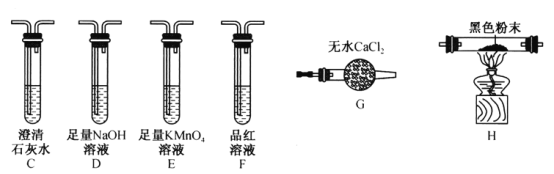
①实验装置连接的合理顺序为A、B、___________。装置H中黑色粉末是___________。
②能证明产物中有CO的现象是____________________________________________。
③若含有SO2,E装置的作用是______________________________(用化学方程式说明)。
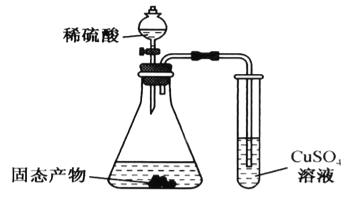
(3)某同学利用下图装置验证固态产物,能证明固态产物中含有Na2S的现象是___________。若实验中发现固态产物完全反应后,锥形瓶底部还产生少量黄色沉淀,说明固体产物中除含有Na2S外,还含有少量的___________(填一种可能的物质)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现。下列有关说法中,正确的是( )
A.H2与H3中不存在氢键B.O2 与O4互为同位素
C.C60 分子中有范德华力D. N5+中含有35个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1的H2SO3溶液中滴加0.2mol·L-1 NaOH溶液,含硫微粒的物质的量(n)变化曲线如图所示,下列有关说法正确的是

A. 曲线Ⅱ代表H2SO3的浓度
B. a、b、c三个交点处水的电离程度大小:a<b<c
C. 当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为:c(Na+)>(HSO3ˉ) >c(SO32-)>c(H+)>c(OHˉ)
D. 若c点pH=6.5,则Ka2(H2SO3)=10-7.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用惰性电极电解200 mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。

(1)下列说法正确的是______(填序号)。
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应为2H++2e-==H2↑和4OH--4e-==2H2O+O2↑
C.从P点到Q点时收集到的混合气体的平均摩尔质量为12 g·mol-1
D.OP段表示H2和O2混合气体的体积变化,PQ段表示O2的体积变化
(2)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________mol。
(3)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为________mol。
Ⅱ. 金属腐蚀是我们日常生活的常见现象(如图所示)。

(1)如图铜板上铁铆钉处的腐蚀属于____腐蚀。
(2)分析此腐蚀过程,下列有关说法中,不正确的是____。
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com