
【题目】用零价铁(Fe)进行水体脱氮、(去除水体中的NO3-),已成为环境修复研究的热点之一。
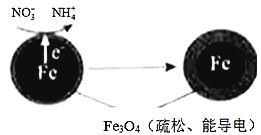
(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是________,正极的电极反应式是_________。
(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
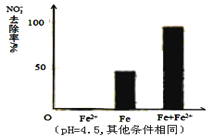
针对假设I:做对比实验,结果如图所示,可得到的结论是_______。
②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为_______________,加入Fe2+提高NO3-去除率的原因:____________。
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为_________________。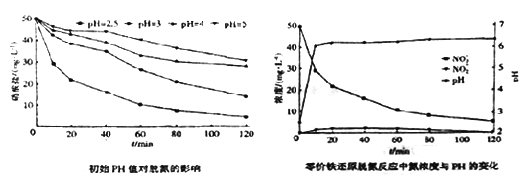
【答案】 铁 NO3-+8e-+l0H+=NH4++3H2O 本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率 Fe2++2FeO(OH)=Fe3O4+2H+ Fe2+将不导电的FeO (OH)转化为可导电的Fe3O4,利于电子的转移 初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足
【解析】 (1). ①Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极;②NO3―在正极得电子,还原成NH4+ ,根据图2信息可知,在酸性环境中,正极的电极反应式是 NO3-+8e-+l0H+=NH4++3H2O ,答案: (1). 铁 (2). NO3-+8e-+l0H+=NH4++3H2O
(2)①从图3的实验结果可以看出,单独加入Fe2+ 时,NO3―的去除率为0,Fe2+ 不能直接还原NO3―,而Fe和Fe2+ 共同加入时NO3―的去除率比单独加Fe时高,因此可得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率 答案: (3). 本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率
②证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为Fe2++2FeO(OH)=Fe3O4+2H+ ,加入Fe2+提高NO3-去除率的原因: Fe2+将不导电的FeO (OH)转化为可导电的Fe3O4,利于电子的转移。答案:(4). Fe2++2FeO(OH)=Fe3O4+2H+ (5). Fe2+将不导电的FeO (OH)转化为可导电的Fe3O4,利于电子的转移
(3)根据实验结果可知Fe2+ 的作用时将不导电的FeOOH转化为可导电的Fe3O4,而NO3―的去除率由铁的最终物质形态确定,因此实验初始pH会影响Fe2+ 的含量,故答案:初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.2molL﹣1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A. ③①④②⑤ B. ①③⑤④② C. ③②①⑤④ D. ⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定条件下,一定大量共存的是
A. 在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3-、Na+
B. pH=1的溶液中: Cu2+、Al3+、SO42-、NO3-
C. 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D. 水电离出的c(H+)=1×10-12 mol/L的溶液中:Na+、Mg2+、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
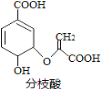
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com