
20.(12分)Zn?MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是_________ ___。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:计算题
(本题共14分)
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为 (精确到0.001)。
往滤液中通入CO2,发生的反应为: 2NaAl(OH)4 + CO2→2Al(OH)3↓+ Na2CO3+ H2O,若生成0.5 mol Na2CO3,则生成Al(OH)3 mol。
52.有反应Al2O3(s)+ Na2CO3(s)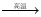 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+ Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
Al2O3 | Fe2O3 | Na2O | |
质量分数 | 0.065 | 0.850 | 0.029 |
每1t铝土精矿生产时:得到的赤泥 t(精确到0.001,下同);可制得Al2O3得 t;需要补充购买Na2CO3 kg。
53.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a= ;
求b的值(精确到0.001):
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定的溶液中一定能大量共存的是
A.使酚酞变红的溶液:Na+、Cu2+、Cl-、HCO3-
B.使石蕊变红的溶液:K+、Fe3+、NO3-、I-
C.0.1mol/L的NaCl溶液.Al3+、NH4+、SO42-、NO3-
D.pH=1的硫酸溶液:Ba2+、K+、OH-、CH3COO-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省晋中市高三1月考前适应性训练理综化学试卷(解析版) 题型:选择题
化学与生活息息相关。下列说法错误的是
A.喝下汽水后常会打嗝,说明气体的溶解度随温度升高而减小
B.自行车钢架生锈主要是电化学腐蚀所致
C.可以通过灼烧的方法鉴别锦纶和蚕丝
D.凡是有食品添加剂的食物对人体健康均有害,不可食用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:选择题
某硫酸厂废气中SO2的回收利用方案如下图所示。下列说法不正确的是

A.X可能含有2种盐
B.a是SO3
C.Y可能含有(NH4)2SO4
D.(NH4)2S208中S的化合价不可能为+7
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:实验题
16.(10分)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入 500mL容量瓶中,恰好至刻度线,配成待测液备用。请改正以上操作中出现的五处错误。
① ,② ,③ ,
④ ,⑤ 。
(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。
A.移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读数(滴定管)开始时仰视,终点时俯视
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
9.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:实验题
(14分)某兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧,为了确定其产物并进行试验论证,某同学设计了下列装置进行试验(已知PdCl2能被CO还原为Pd),请回答下列问题:

(1)上图装置2中应盛放__________溶液.
(2)为了使反应随开随用,随关随停,上图方框内应选用_____装置(填上图字母代号).
(3)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行1装置的操作,待装置______(填数字编号)中出现_______________现象时,再点燃酒精灯.
(4)①若装置6中有黑色沉淀(Pd)生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_________.
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com