
16����10�֣�ʵ������һƿ�����Ȼ��Ƶ��������ƹ����Լ������ⶨNaOH����������ԼΪ82.0%��Ϊ����֤�䴿�ȣ���Ũ��Ϊ0.2mol/L��������еζ����Իش��������⣺
(1)������ƽ����5.0g�����Լ���������ˮ�ܽ����ձ��У�����Ȼ������ֱ��ת�� 500mL����ƿ�У�ǡ�����̶��ߣ���ɴ���Һ���á���������ϲ����г��ֵ��崦����
�� ���� ���� ��
�� ���� ��
(2)��������װ��25.00mL �ζ����У�����Һ��λ���� ���������¿̶ȡ�
(3)ȡ20.00mL����Һ�����ⶨ������ʵ���������Ҫ������ ��
�� �Լ���ָʾ��ʱ���ζ�����Һ��ɫ�� �պ��� ɫʱΪֹ��
(4)�ζ����յ����������ȥ20.00mL������NaOH����������Ϊ ��
(5)�Է����ζ���������������Щʵ���������� ��
A���ƴ���Һ������ƿʱ��δϴ���ձ�
B����ʽ�ζ���������ˮϴ�Ӻ�ֱ��װ����
C���ζ�ʱ����Ӧ����ҡ��̫���ң�������Һ�彦��
D���ζ����յ�ʱ���ζ��ܼ�������Һ��
E���������ζ��ܣ���ʼʱ���ӣ��յ�ʱ����
��1����δ��ȴ��ת�ƣ����ձ�δϴ�ӣ���δ�ò�������������δ�ý�ͷ�ιܵμ����̶��ߣ���δ��ҡ�ȡ�
��2����ʽ��0�̶Ȼ�0�̶�����ijһλ��
��3����ʽ�ζ��ܡ���ƿ����̪��dz��ɫ����
��4��80%
��5��A��C��E
��������
�����������1���ܽ�����ҺӦ��ȴ���ò���������ת�����ҡ�ȣ���2������Ӧ����ʽ�ζ�����ȡ����3������ҺΪNaOH��ѡ���ʽ�ζ��ܣ��÷�̪��ָʾ��ʱ���ζ�ǰ����̪�����dz��ɫ������ζ��յ�ʱ�۲쵽��Һ��ɫ�ɻ�dz��ɫ��Ϊ��ɫ����4��c��HCl��=0.2mol/L��V��HCl��=20.00mL��V��NaOH��=20.00mL����c���ᣩV���ᣩ=c���V�����֪c��NaOH��=0.2mol/L����500mL��Һ��NaOH�����ʵ���Ϊ0.5L��0.2mol/L=0.1mol����NaOH������Ϊ0.1mol��40g/mol=4.0g������5.0g��Ʒ��NaOH����������Ϊ ��100%=80%����5��A��ת�ƴ���Һ������ƿʱ��δϴ���ձ���NaOH�����ʵ������٣���������٣�����ƫ�ͣ�B����ʽ�ζ���������ˮϴ�Ӻ�ֱ��װ���ᣬ�����Ũ��ƫ�ͣ�������ƫ���ƫ��C���ζ�ʱ����Ӧ����ҡ��̫���ң�������Һ�彦����NaOH�����ʵ������٣���������٣�����ƫ�ͣ�D���ζ����յ�ʱ���ζ��ܼ�������Һ�Σ���������ƫ���ƫ��E������ʽ�ζ��ܿ�ʼʱ���ӣ�����ƫ�����յ�ʱ���ӣ�����ƫС������֮��ƫС����������٣�����ƫ�͡�
��100%=80%����5��A��ת�ƴ���Һ������ƿʱ��δϴ���ձ���NaOH�����ʵ������٣���������٣�����ƫ�ͣ�B����ʽ�ζ���������ˮϴ�Ӻ�ֱ��װ���ᣬ�����Ũ��ƫ�ͣ�������ƫ���ƫ��C���ζ�ʱ����Ӧ����ҡ��̫���ң�������Һ�彦����NaOH�����ʵ������٣���������٣�����ƫ�ͣ�D���ζ����յ�ʱ���ζ��ܼ�������Һ�Σ���������ƫ���ƫ��E������ʽ�ζ��ܿ�ʼʱ���ӣ�����ƫ�����յ�ʱ���ӣ�����ƫС������֮��ƫС����������٣�����ƫ�͡�
���㣺����к͵ζ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ��о�����������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
�����12�֣�������Ҫ�ķǽ���Ԫ�ء�
28.�йذ��ף�P4����������ȷ���� ��ѡ���ţ���
a.������CS2 b������ȼ c����������4��P-P��
P4�ڹ�������NaOH��Һ�л�����PH3�����NaH2PO2���������ƣ���д���÷�Ӧ�Ļ�ѧ����ʽ ��
�ɸ÷�Ӧ����֪H3PO2Ϊ Ԫ�ᡣ��NaH2PO2����֤�����������ᣬ����Ҫ�������� ��
29��NaH2PO2����������������Ni2+���ý��С���ѧ������������ľ�ı�������һ��Ni-P�Ͻ𣩣���Ӧ����Ԫ�ػ��ϼ۷����ı仯�� ��ѡ���ţ���
a������ b.���� c���������ֽ���
30��25��ʱ��HF��Ki = 3.6��10 �C 4 ��
H3PO4�� Ki1= 7.5��10 -3��Ki2= 6.2��10 -8��Ki3= 2.2��10 -13��
�����±���������� ��ѡ���ţ���
a��0.1mol/L��H3PO4��Һ��c(H+)��0.1mol/L
b��NaF��H3PO4��Ӧ����NaH2PO4
c.0.1mol/L����Һ��pH�ɴ�С��˳���ǣ�Na3PO4��Na2HPO4��NaF��NaH2PO4
31.Ag3PO4��������ˮ�Ļ�ɫ���壬����ƽ���ƶ���ԭ������������ϡ�����ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�����и�����ѧ�ڵڶ��ν�ѧ�������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ������������ϢϢ��ء������й�˵���������
A������ȼ�ջ�ʯȼ�����������������ԭ��֮һ
B��ȼ������ͼ�������β���ŷŶ��ܼ�������IJ���
C���Ӻ�ˮ����ȡ���ʶ�����ͨ����ѧ��Ӧ����ʵ��
D�����ۡ���ά�غ͵����ʶ������л��߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͪ��CH3COCH3����ij�ܼ���ڴ��������·�����Ӧ�� ȡ��ͬŨ�ȵ�
ȡ��ͬŨ�ȵ� ���ֱ���40���60��ʱ�������ת����
���ֱ���40���60��ʱ�������ת���� ��ʱ��仯�Ĺ�ϵ���ߣ�
��ʱ��仯�Ĺ�ϵ���ߣ� ����ͼ��ʾ������˵����ȷ����
����ͼ��ʾ������˵����ȷ����

A��b����40��ʱ ��
�� ����
����
B�������¶ȿ����̸÷�Ӧ��ƽ���ʱ�䲢�����ƽ��ת����
C������ѹǿ�����̸÷�Ӧ��ƽ���ʱ�䲢�����ƽ��ת����
D��������Ӧ���淴ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�γ��и߶�12���¿���ѧ�Ծ��������棩 ���ͣ������
20��(12��)Zn?MnO2�ɵ��Ӧ�ù㷺����������Һ��ZnCl2��NH4Cl�����Һ��
��1���õ�صĸ���������________����ع���ʱ����������________(�������������)��
��2����ZnCl2��NH4Cl�����Һ�к�������Cu2+�������ij�缫�ĸ�ʴ������Ҫԭ����__________________��
����ȥCu2�������ѡ�������Լ��е�________(�����)��
a��NaOH b��Zn c��Fe d��NH3��H2O
��3��MnO2����������֮һ����ʯīΪ�缫������ữ��MnSO4��Һ�������ĵ缫��Ӧʽ��_________ ___��������·��ͨ��2 mol���ӣ�MnO2�����۲���Ϊ________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�γ��и߶�12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
11�������£���1.000 mol��L��1�������20.00 mL 1.000 mol��L��1��ˮ�У���ҺpH���¶��������������仯��������ͼ��ʾ�������й�˵����ȷ����
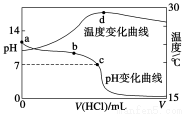
A��a����ˮ�������c(H��)��1.0��10��14 mol��L��1
B��b�㣺c(NH4+)��c(NH3��H2O)��c(Cl��)
C��c�㣺c(Cl��)��c(NH4+)
D��d�����Һ�¶����½�����Ҫԭ����NH3��H2O��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�γ��и߶�12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
4�����е��뷽��ʽ����ȷ����
A��NaHCO3����ˮ��NaHCO3=Na+��H+��CO32��
B��NaHSO4�ۻ���NaHSO4=Na+��H+��SO42��
C��HF��������ˮ�У�2HF H+��HF2һ
H+��HF2һ
D����NH4��2 SO4����ˮ����NH4��2 SO4��2NH4+��SO42һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ��һ��ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A�����¡���ѹ�£�16 g O3�к��е���ԭ����Ϊ
B��7.8 g Na2O2��ˮ��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.2 NA
C��0.1 mol Fe��0.1 mol Cl2��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.3NA
D����״���£�11.2 L H2O�к��е���ԭ����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����������и�����ѧ����ĩ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾ,��ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ.��֪�Ƽ�������������ʵ�����Ϊ0.1 mol,ˮ������Ϊ100 g.��
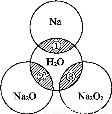
����˵����ȷ����
A��Na2O2����������������Ŀ֮��Ϊ1��1
B����Ӧ������ܲ���0.05 mol O2
C����Ӧ�ٵ����ӷ���ʽΪNa+2H2O==Na++2OH-+H2��
D���١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С��˳��Ϊ��>��>��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com