
【题目】根据下表所示化学反应与数据关系:
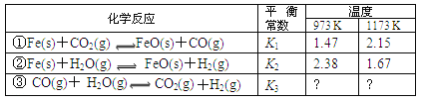
请回答:
(1)反应①是__填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式__。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=__(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施是__。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
(5)若反应③的逆反应速率与时间的关系如图所示:
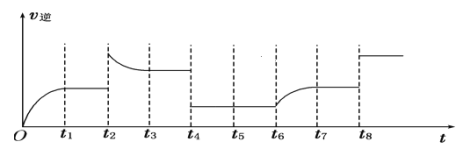
可见反应在t1、t3、t7时都达到了平衡,而t2、t4、t8时都改变了一种条件,请判断改变的可能是什么条件:t2时__;t4时__;t8时__。
【答案】吸热 K3=![]()
![]() C 升高温度或增大CO2的浓度(增大H2的浓度) 减小压强(或增大容器容积) 使用催化剂或加压(减小容器的容积)
C 升高温度或增大CO2的浓度(增大H2的浓度) 减小压强(或增大容器容积) 使用催化剂或加压(减小容器的容积)
【解析】
(1) 由表中数据可知,反应①中温度越高,平衡常数越大,说明升高温度平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应;
(2)反应③的平衡常数K3的表达式K3=![]() ;
;
(3)反应②-反应①得到反应③,则平衡常数K3为反应②与反应①的平衡常数商,故K3=![]() ;
;
(4)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而![]() ,故反应③温度越高,平衡常数越小,即正反应为放热反应;
,故反应③温度越高,平衡常数越小,即正反应为放热反应;
A.缩小反应容器的容积,压强增大,反应前后气体体积不变,平衡不移动,故A错误;
B.扩大反应容器的容积,压强减小,反应前后气体体积不变,平衡不移动,故B错误;
C.升高温度,平衡向逆向移动,故C正确;
D.使用合适的催化剂,同等程度加快反应速率,平衡不移动,故D错误;
答案选C;
(5) t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,该反应正反应是一个反应前后气体体积不变的放热反应,不能是增大压强,可能是升高温度或者增大生成物的浓度;t4时逆反应速率减小,但平衡不移动,反应正反应是一个反应前后气体体积不变的反应,可能是减小压强(或增大容器容积);t8时反应速率增大,但平衡不移动,该反应正反应是一个反应前后气体体积不变的反应,能为增大压强或使用催化剂。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】酚酞为常用的酸碱指示剂,其结构如图所示,下列有关酚酞的说法正确的是
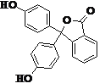
A.含有 3 种官能团
B.可以发生取代反应、消去反应、加成反应、氧化反应
C.分子式为 C20H14O4
D.1 mol 酚酞分别与 NaOH、溴水和 H2 发生反应时,消耗 NaOH、Br2 和 H2 的物质的量的最大值分别为2 mol、4 mol 和10 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒来势汹汹,但是它依然可防可控。84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。回答下列问题:
(1)在周期表中与Mn相邻且未成对电子数最多的原子的价电子排布式为:___。
(2)K和O第一电离能I1(K)___I1(O)(填“大于”或“小于”)。原因是___。
(3)浓盐酸为HCl的水溶液,HCl极易溶于水的原因___,HCl和H2O中沸点较高的是___,其原因是___。
(4)KClO3晶体中,阴离子的空间构型为___,Cl的杂化轨道与O的2p轨道形成___键。
(5)金属K晶体为体心立方堆积,K原子半径为rpm,摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则晶体密度为___g﹒cm-3。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟合铝酸钠(Na3AlF6)俗称冰晶石,微溶于水,可用作陶瓷乳白剂、树脂橡胶的耐磨填充剂等。实验室以萤石(CaF2,难溶于水)、石英和纯碱等为原料可制备Na3AlF6,实验步骤如下:
Ⅰ.将萤石(CaF2)、石英和纯碱按一定比例混合后煅烧并释放出CO2;
Ⅱ.……
Ⅲ.在浸取液中加入稀硫酸调节pH,再加入硫酸铝,充分反应后过滤,洗涤烘干后得到六氟合铝酸钠。
回答下列问题:
(1)Na3AlF6中铝元素的化合价为__________。
(2)步骤Ⅰ中煅烧原料混合物时,盛装原料混合物的仪器名称为___________;混合物煅烧后除生成CO2、CaSiO3外还有一种产物(二元化合物),该物质的化学式为______________。
(3)步骤Ⅱ的具体内容是__________________。
(4)通过实验探究不同pH时氟离子的去除率,即对多份相同量的浸取液调节至不同pH后,再分别加入等量硫酸铝,得到了溶液中残留氟浓度和氟去除率随溶液pH的变化关系如图所示。则步骤Ⅲ中最佳pH为_________;图中当pH增大时,氟去除率下降的原因是_______________________________________。
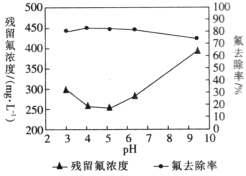
(5)步骤Ⅲ中检验过滤后的固体已洗涤干净的方法是_______________________________。
(6)写出一种能将含氟废水中氟离子去除的可行方法:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
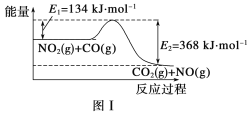
【题目】图Ⅰ是NO2(g)+CO(g)![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是( )
A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示(球的大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中正确的是( )。
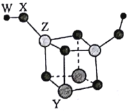
A.W和X可以组成原子个数比为2:1和1:1的离子化合物
B.工业上可采用电解Z的熔融氯化物的方法制得单质Z
C.Z的最高价氧化物对应水化物的碱性比Y的强
D.X、Y、Z三种元素的离子半径由小到大顺序为Z<Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关事实及原因的分析中,错误的是![]()
![]()
事实 | 原因 | |
A. | 分子内不同化学键之间存在键角 | 共价键具有方向性 |
B. |
|
|
C. | 不含金属元素的化合物均是共价化合物 | 非金属元素间不能形成离子键 |
D. |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机知识正确的有_____个
①![]() 名称:2,3—二甲基—1,5—戊二烯 ②乙烯的实验式;CH2
名称:2,3—二甲基—1,5—戊二烯 ②乙烯的实验式;CH2
③用质谱仪和红外光谱均可以获得有机物所含化学键或官能团信息
④乙醇的分子式:C2H5OH ⑤苯乙炔共线的原子最多有6个
⑥对甲基苯甲醇的结构简式:![]()
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)2![]() (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为_______;AsH3的电子式为______;
(2)下列说法正确的是_________;
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为__________(填化学式);
(4)“一级沉砷”中FeSO4的作用是________。
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为__________;
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成![]() ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com