
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)2![]() (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为_______;AsH3的电子式为______;
(2)下列说法正确的是_________;
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为__________(填化学式);
(4)“一级沉砷”中FeSO4的作用是________。
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为__________;
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成![]() ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
【答案】第四周期第VA族 ![]() a CaSO4 沉淀过量的S2-,使As2S3(s)+3S2-(aq)2
a CaSO4 沉淀过量的S2-,使As2S3(s)+3S2-(aq)2![]() (aq)平衡逆向移动,使一级沉砷更完全 H3AsO3+H2O2= H3AsO4+H2O 4FeS2+15O2+14H2O=4Fe(OH)3+8
(aq)平衡逆向移动,使一级沉砷更完全 H3AsO3+H2O2= H3AsO4+H2O 4FeS2+15O2+14H2O=4Fe(OH)3+8![]() +16H+
+16H+
【解析】
废水中砷元素主要以亚砷酸(H3AsO3)形式存在,加入硫化钠生成As2S3沉淀,为防止As2S3与硫离子反应再次溶解,所以再加入硫酸亚铁除去过量的硫离子,过滤得到As2S3和FeS,滤液中加入过氧化氢将亚砷酸氧化成砷酸,亚铁离子氧化成铁离子,再加入CaO沉淀砷酸根、铁离子、硫酸根,得到Ca2(AsO4)2、FeAsO4、Fe(OH)3、CaSO4沉淀和低浓度含砷废水。
(1)As元素为33号元素,与N元素同主族,位于第四周期第VA族;AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键,电子式为:![]() ;
;
(2)a.同周期主族元素自左而右非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下非金属性减弱,最高价氧化物对应水化物酸性减弱,酸性:H2SO4>H3PO4>H3AsO4,故a正确;
b.同周期主族元素自左而右原子半径减小,同主族自上而下原子半径依次增大,原子半径:As>P>S,故b错误;
c.同主族元素自上而下第一电离能减小,P和S同周期,但是P原子3p能级为半满状态,更稳定,第一电离能更大,所以第一电离能P>S>As,故c错误;
综上所述选a;
(3)根据分析可知沉淀为微溶物CaSO4;
(4)As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)2![]() (aq),所以需要加入FeSO4除去过量的硫离子,使平衡逆向移动,一级沉砷更完全;
(aq),所以需要加入FeSO4除去过量的硫离子,使平衡逆向移动,一级沉砷更完全;
(5)含砷物质物质为H3AsO3,加入过氧化氢可以将其氧化成H3AsO4,根据电子守恒和元素守恒可得化学方程式为H3AsO3+H2O2= H3AsO4+H2O;
(6)根据题意可知FeS2被O2氧化生成Fe(OH)3、![]() ,根据元素守恒可知反应物应该还有H2O,FeS2整体化合价升高15价,一个O2降低4价,所以二者的系数比为4:15,再根据元素守恒可得离子方程式为4FeS2+15O2+14H2O=4Fe(OH)3+8
,根据元素守恒可知反应物应该还有H2O,FeS2整体化合价升高15价,一个O2降低4价,所以二者的系数比为4:15,再根据元素守恒可得离子方程式为4FeS2+15O2+14H2O=4Fe(OH)3+8![]() +16H+。
+16H+。


科目:高中化学 来源: 题型:
【题目】根据下表所示化学反应与数据关系:
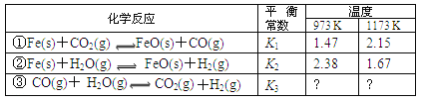
请回答:
(1)反应①是__填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式__。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=__(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施是__。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
(5)若反应③的逆反应速率与时间的关系如图所示:
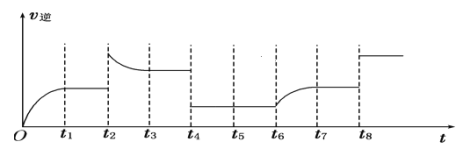
可见反应在t1、t3、t7时都达到了平衡,而t2、t4、t8时都改变了一种条件,请判断改变的可能是什么条件:t2时__;t4时__;t8时__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。下列说法正确的是
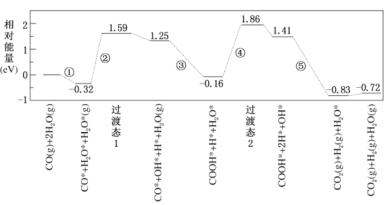
A.水煤气变换反应的△H>0
B.步骤③的化学方程式:CO*+OH*+H2O(g)=COOH*+H2O*
C.步骤⑤只有非极性键HH键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕固体,H的焰色呈黄色。

请回答下列问题:
(1)A物质的化学式为________,H物质的名称为______________________。
(2)G![]() J的实验现象是_________________;化学方程式为___________________。
J的实验现象是_________________;化学方程式为___________________。
(3)D与C高温下反应的化学方程式为:________________。
(4)D物质与盐酸恰好反应的离子方程式为__________,所得溶液的颜色为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
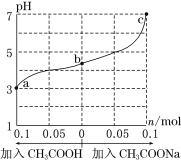
A.b点混合液中c(Na+)>c(CH3COO-)
B.加入CH3COOH过程中,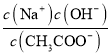 增大
增大
C.c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
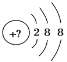
(1)该微粒是中性微粒,这种微粒的符号是________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性重铬酸盐溶液中加入乙醚和H2O2发生反应![]() +4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
+4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
A.溶液出现蓝色的反应属于非氧化还原反应
B.乙醚可用乙醇代替
C.该方法既可用于检验H2O2,又可用于检验![]()
D.水层逐渐变为绿色发生的离子反应为4CrO(O2)2+ 12H+=4Cr3++ 6H2O+7O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子。
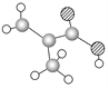
该物质的结构简式为__,该物质中所含官能团的名称为__。
(2)下列各组物质:①O2和O3②H2、D2、T2③12C和14C④CH3CH2CH2CH3和(CH3)2CH2CH3⑤乙烷和丁烷⑥CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5互为同系物的是__,互为同分异构体的是__,互为同位素的是__,互为同素异形体的是__,是同一物质的是__。
(3)酚酞是常用的酸碱指示剂,其结构简式如图所示:
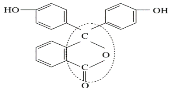
①酚酞的分子式为__。
②从结构上分析酚酞可看作__。
A.烯烃 B.芳香化合物 C.醇类物质 D.酚类物质 E.醚类物质 F.酯类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟。 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝。 | 溶液变深紫色;经检验溶液含单质碘。 |
下列对实验的分析合理的是
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com