
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。下列说法正确的是
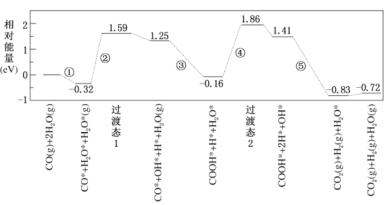
A.水煤气变换反应的△H>0
B.步骤③的化学方程式:CO*+OH*+H2O(g)=COOH*+H2O*
C.步骤⑤只有非极性键HH键形成
D.该历程中最大能垒(活化能)E正=1.70eV
【答案】B
【解析】
分析图象可知,水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,故反应过程中放出能量,结合图象进行分析判断。
A.根据水煤气变换反应并结合反应历程相对能量可知,CO(g)+H2O(g)的能量高于CO2(g)+H2(g)的能量,反应的焓变ΔH小于0,A项错误;
B.结合此图分析判断,③是发生的过渡反应:CO*+OH*+H2O(g)=COOH*+H2O*,B项正确;
C.由图可知步骤⑤中H-O键,在原反应物中已经存在,则步骤⑤形成的化学键包括极性键C=O,非极性键H-H键形成,C项错误;
D.该历程中最大能垒(活化能)E正=1.86eV-(-0.16eV)=2.02eV,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】新型冠状病毒来势汹汹,但是它依然可防可控。84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。回答下列问题:
(1)在周期表中与Mn相邻且未成对电子数最多的原子的价电子排布式为:___。
(2)K和O第一电离能I1(K)___I1(O)(填“大于”或“小于”)。原因是___。
(3)浓盐酸为HCl的水溶液,HCl极易溶于水的原因___,HCl和H2O中沸点较高的是___,其原因是___。
(4)KClO3晶体中,阴离子的空间构型为___,Cl的杂化轨道与O的2p轨道形成___键。
(5)金属K晶体为体心立方堆积,K原子半径为rpm,摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则晶体密度为___g﹒cm-3。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关事实及原因的分析中,错误的是![]()
![]()
事实 | 原因 | |
A. | 分子内不同化学键之间存在键角 | 共价键具有方向性 |
B. |
|
|
C. | 不含金属元素的化合物均是共价化合物 | 非金属元素间不能形成离子键 |
D. |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机知识正确的有_____个
①![]() 名称:2,3—二甲基—1,5—戊二烯 ②乙烯的实验式;CH2
名称:2,3—二甲基—1,5—戊二烯 ②乙烯的实验式;CH2
③用质谱仪和红外光谱均可以获得有机物所含化学键或官能团信息
④乙醇的分子式:C2H5OH ⑤苯乙炔共线的原子最多有6个
⑥对甲基苯甲醇的结构简式:![]()
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.将铜丝插入稀硝酸中:Cu+4H++2![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.硫酸铜溶液与过量的氨水反应:Cu2++4NH3H2O=[Cu(NH3)4]2++4H2O
D.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁过程中涉及到的主要反应有:
i.C(s)+O2(g)=CO2(g)△H1=-393kJ/mol
ii.C(s)+CO2(g)=2CO(g)△H2=+172kJ/mol
iii.Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H3
2Fe(s)+3CO2(g)△H3
iv.2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g)△H4=+460kJ/mol
4Fe(s)+3CO2(g)△H4=+460kJ/mol
回答下列问题:
(1)反应iv_________(填“能”或“不能”)在任何温度下自发进行。
(2)△H3=_________kJ/mol。
(3)T1时,向容积为10L的恒容密闭容器中加入3molFe2O3和3molCO发生反应iii,5min时达到平衡,平衡时测得混合气体中CO2的体积分数为80%。
①0~5min内反应的平均速率v(CO2)=_________molL-lmin-l。
②该温度下反应的平衡常数为_________。
③若将平衡后的混合气体通入1L3.6mol/L的NaOH溶液,恰好完全反应,反应的离子方程式为_________,所得溶液中离子浓度由大到小的顺序是_________
④下列选项中能够说明该反应已经达到平衡状态的是_________(填序号)。
a.Fe2O3的物质的量不再变化
b.体系的压强保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO和生成CO2的物质的量相等
(4)一定条件下进行反应iii,正向反应速率与时间的关系如图所示,t2时刻改变了一个外界条件,可能是_________。
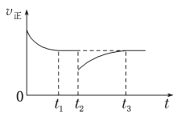 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.向AgNO3中滴加氨水至过量:Ag++NH3H2O=AgOH↓+![]()
B.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
C.向Na2S2O3溶液中加入足量稀硫酸:2![]() +4H+=
+4H+=![]() +3S↓+2H2O
+3S↓+2H2O
D.向苯酚钠溶液中通入少量CO2气体:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +
+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)2![]() (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为_______;AsH3的电子式为______;
(2)下列说法正确的是_________;
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为__________(填化学式);
(4)“一级沉砷”中FeSO4的作用是________。
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为__________;
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成![]() ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com