
【题目】工业炼铁过程中涉及到的主要反应有:
i.C(s)+O2(g)=CO2(g)△H1=-393kJ/mol
ii.C(s)+CO2(g)=2CO(g)△H2=+172kJ/mol
iii.Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H3
2Fe(s)+3CO2(g)△H3
iv.2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g)△H4=+460kJ/mol
4Fe(s)+3CO2(g)△H4=+460kJ/mol
回答下列问题:
(1)反应iv_________(填“能”或“不能”)在任何温度下自发进行。
(2)△H3=_________kJ/mol。
(3)T1时,向容积为10L的恒容密闭容器中加入3molFe2O3和3molCO发生反应iii,5min时达到平衡,平衡时测得混合气体中CO2的体积分数为80%。
①0~5min内反应的平均速率v(CO2)=_________molL-lmin-l。
②该温度下反应的平衡常数为_________。
③若将平衡后的混合气体通入1L3.6mol/L的NaOH溶液,恰好完全反应,反应的离子方程式为_________,所得溶液中离子浓度由大到小的顺序是_________
④下列选项中能够说明该反应已经达到平衡状态的是_________(填序号)。
a.Fe2O3的物质的量不再变化
b.体系的压强保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO和生成CO2的物质的量相等
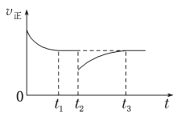
(4)一定条件下进行反应iii,正向反应速率与时间的关系如图所示,t2时刻改变了一个外界条件,可能是_________。
 .
.
【答案】不能 -28 0.048 64 2CO2+3OHˉ=CO![]() +HCO
+HCO![]() +H2O c(Na+)>c(HCO
+H2O c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )> c(OHˉ) > c(H+) ac 恒压条件下充入一定量的二氧化碳气体
)> c(OHˉ) > c(H+) ac 恒压条件下充入一定量的二氧化碳气体
【解析】
(3)初始投料为3molFe2O3和3molCO,Fe2O3和Fe均为固体,容器恒容,则根据反应方程式可知反应过程中气体的总物质的量不变,始终为3mol;平衡时CO2的体积分数为80%,即物质的量分数为80%,所以n(CO2)=3mol×80%=2.4mol,n(CO)=0.6mol。
(1)当△G=△H-T△S<0时反应可以自发进行,反应iv的焓变△H4>0,该反应为气体分子数增多的反应,所以△S>0,不能满足任何温度下△G都小于0,所以该反应不能在任何温度下自发进行;
(2)已知:i.C(s)+O2(g)=CO2(g)△H1=-393kJ/mol
ii.C(s)+CO2(g)=2CO(g)△H2=+172kJ/mol
iii.Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H3
2Fe(s)+3CO2(g)△H3
iv.2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g)△H4=+460kJ/mol
4Fe(s)+3CO2(g)△H4=+460kJ/mol
由盖斯定律可知![]() (iv-ii×3)得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=
(iv-ii×3)得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=![]() [+460kJ/mol-(+172kJ/mol)×3]= -28kJ/mol;
[+460kJ/mol-(+172kJ/mol)×3]= -28kJ/mol;
(3)①根据分析可知0-5min内△n(CO2)=2.4mol,容器的容积为10L,所以v(CO2)=![]() =0.048mol·L-1·min-1;
=0.048mol·L-1·min-1;
②平衡时c(CO2)=0.24mol/L,c(CO)=0.06mol/L,平衡常数K=![]() =64;
=64;
③混合气体中n(CO2)=2.4mol,1L3.6mol/L的NaOH溶液中n(NaOH)=3.6mol,n(CO2): n(NaOH:2:3,所以该反应的离子方程式为2CO2+3OHˉ=CO![]() +HCO
+HCO![]() +H2O,反应后溶液中的溶质为等物质的量浓度的Na2CO3和NaHCO3;Na+不发生水解,所以c(Na+)最大;碳酸根的水解程度大于碳酸氢根,所以c(HCO
+H2O,反应后溶液中的溶质为等物质的量浓度的Na2CO3和NaHCO3;Na+不发生水解,所以c(Na+)最大;碳酸根的水解程度大于碳酸氢根,所以c(HCO![]() )>c(CO
)>c(CO![]() ;溶液显碱性,所以c(OHˉ) > c(H+),水解是微弱的,所以溶液中离子浓度由大到小为c(Na+)> c(HCO
;溶液显碱性,所以c(OHˉ) > c(H+),水解是微弱的,所以溶液中离子浓度由大到小为c(Na+)> c(HCO![]() )>c(CO
)>c(CO![]() )> c(OHˉ) > c(H+);
)> c(OHˉ) > c(H+);
④a.固体的物质的量不再变化,说明正逆反应速率相等,反应达到平衡状态,故a能说明;
b.反应前后气体物质的量始终不变,体系的压强始终保持不变,不能说明反应达到平衡状态,故b不能说明;
c.反应前后气体质量变化,气体物质的量不变,所以未平衡时混合气体的平均摩尔质量会发生改变,当其保持不变说明反应达到平衡状态,故c能说明;
d.消耗CO和生成CO2均为正反应,只要反应发生单位时间内消耗CO和生成CO2的物质的量就相等,故其不能说明反应达到平衡状态,故d不能说明;
综上所述选ac;
(4)据图可知t2时刻正反应速率突然减小,然后又逐渐增大,之后达到平衡时与原平衡的反应速率相等,说明反应物的浓度先是被减小,然后又逐渐增大,则该条件改变后平衡逆向移动,该反应正反应为放热反应,升高温度可以使平衡逆向移动,但升高温度不能使正反应速率减小。而该反应前后气体分子数不变,若保持压强不变向密闭容器中充入二氧化碳,则容器的体积增大导致一氧化碳的浓度减小,正反应速率减小,则二氧化碳的浓度增大了,逆反应速率大于正反应速率,平衡向逆反应方向移动,根据温度不变K=![]() 不变,且压强不变时气体的浓度不变,所以再次平衡时正反应速率与原平衡相等。因此,改变的条件可能是:恒压条件下充入一定量的二氧化碳气体。
不变,且压强不变时气体的浓度不变,所以再次平衡时正反应速率与原平衡相等。因此,改变的条件可能是:恒压条件下充入一定量的二氧化碳气体。


科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是由4个碳原子结合成的4种有机物(氢原子没有画出)
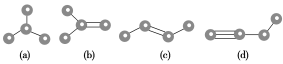
(1)写出有机物(a)的系统命名法的名称________________________。
(2)有机物(a)有一种同分异构体,试写出该同分异构体的结构简式________。
(3)上述有机物中与(c)互为同分异构体的是______(填代号)。
(4)任写一种与(d)互为同系物的有机物的结构简式________。
(5)(a)、(b)、(c)、(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸厂的烟气中含有大量的氮氧化物(NOx),将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3[Ce中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是
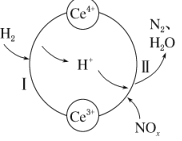
A.该转化过程的实质为NOx被H2还原
B.x=l时,过程II中氧化剂与还原剂的物质的量之比为2:1
C.处理过程中,混合溶液中Ce3+和Ce4+总数减少
D.过程I发生反应的离子方程式:H2+Ce4+=2H++Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。下列说法正确的是
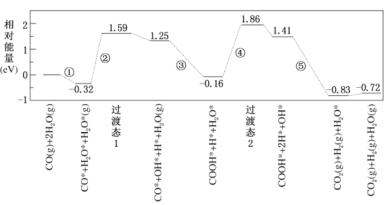
A.水煤气变换反应的△H>0
B.步骤③的化学方程式:CO*+OH*+H2O(g)=COOH*+H2O*
C.步骤⑤只有非极性键HH键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在工业生产中有广泛的应用。
(1)如图为离子交换膜法电解饱和食盐水的原理示意图,写出电解饱和食盐水总离子方程式_________
下列说法正确的是__________

A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 LCl2,便产生2 molNaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3 溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2 ![]() O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液。①高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡,则该过程的离子方程式为________________________。
②电解制高铁酸钾时阳极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕固体,H的焰色呈黄色。

请回答下列问题:
(1)A物质的化学式为________,H物质的名称为______________________。
(2)G![]() J的实验现象是_________________;化学方程式为___________________。
J的实验现象是_________________;化学方程式为___________________。
(3)D与C高温下反应的化学方程式为:________________。
(4)D物质与盐酸恰好反应的离子方程式为__________,所得溶液的颜色为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
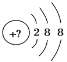
(1)该微粒是中性微粒,这种微粒的符号是________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修-物质结构与性质】
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大,B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是______(填元素符号)
(2)化合物BD3的分子空间构型可描述为______,B的原子轨道杂化类型为______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输.已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为______。CN-与______(一种分子)互为等电子体,则1个CN-中π键数目为______。
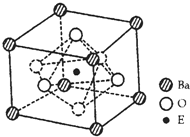
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为______,
在该晶体中,E4+的氧配为数为______。若该晶胞边长为anm可计算该晶体的密度为______g/cm3(阿伏加德罗常数为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com