
����Ŀ��2016��8�¹����ڿ�eLife�Ϸ������㽭ҽ�ƴ�ѧ�ڶ�ҽԺ���㽭��ѧ�����о��������ͺ�Ѵ���˵�һƬ���ģ������䶯��ý�������۵�С�մ�Э�������˰�ϸ�����Ա�������ʵ������ģ�ҵ��ȡNaHCO3��ʵ�鲽�����£�
��һ�������Ӻ�װ�ã����������ԣ���������װ��ҩƷ��
�ڶ���������ijһװ�÷�����Ӧ��ֱ�����������岻������C���ܽ⣬��ͨ����һװ ���в��������壬Ƭ�̺�C�г��ֹ��塣������C��ͨ���������壬ֱ�������й��������
������������C�����õĻ����õ�NaHCO3���塣
���IJ�������Һ�м���������ij�����ĩ����NH4Cl����������
��1����ͼ��ʾװ�õ�����˳���ǣ�a��______��_____��________��b��________����ӿڱ�ţ�
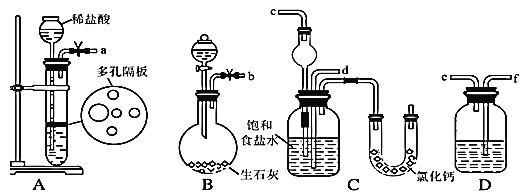
��2�����Aװ�������Եľ��������___________��
��3��A�г�ѡ�õĹ��巴Ӧ��Ϊ_________��D��Ӧѡ�õ�Һ��Ϊ______��
��4��װ����ˮCaCl2��U�ιܵ������� _______��
��5�����IJ����õľ����г�����������NaCl��NaHCO3(Լռ5��~8��)�������һ����ʵ�飬��ʹ�������κ��Լ���֤�����þ������NH4C1����Ҫд������������________��
���𰸡�f e d c �رյ��ɼУ�ͨ������©�����Թ��м�ˮ��ʹ����©���е�ˮ������Թ��е�ˮ�棬����Ƭ�̣�©����ˮ�治�½���˵��Aװ�����������á� ʯ��ʯ�������ʯ���״CaCO3�� ����NaHCO3��Һ����̼��������Һ�� ���ն����NH3 ȡ������������Թ��У����ȣ��������ʧ�����Թܿ��ڱ����н϶�Ĺ������ᡣ
��������
�Ʊ�NaHCO3������ӦʽNaCl��CO2��NH3��H2O=NaHCO3����NH4Cl��Aװ��ʵ������ȡ������̼�����ñ���̼��������Һ��ȥHCl���壬Bװ��ʵ������ȡ���������ͨ�뵽Cװ���н��з�Ӧ����̼�����ƺ��Ȼ�李�
���Ʊ�NaHCO3������ӦʽNaCl��CO2��NH3��H2O=NaHCO3����NH4Cl��װ��A�Ʊ�CO2���Ƴ�CO2����HCl�����ȥ����ΪHCl����NH3�����Ӹ�������a��f��װ��B�Ʊ�NH3��NH3������ˮ��Ҫ��ֹ���������e��d��b��c��
�ʴ�Ϊ��f��e��d��c
�����װ�������ԣ��ȷ����ϵ���ٲ�������˵���ۣ���˼��װ��A�����Բ���Ϊ�رյ��ɼУ�ͨ������©�����Թ��м�ˮ��ʹ����©���е�ˮ������Թ��е�ˮ�棬����Ƭ�̣�©����ˮ�治�½���˵��Aװ�����������á�
�ʴ�Ϊ���رյ��ɼУ�ͨ������©�����Թ��м�ˮ��ʹ����©���е�ˮ������Թ��е�ˮ�棬����Ƭ�̣�©����ˮ�治�½���˵��Aװ�����������ã�
��װ��A�Ʊ�CO2����װ�������շ������ļ���װ�ã�����õķ�Ӧ����ʯ��ʯ�����ʯ���״CaCO3��װ��D�������dz�ȥCO2�л���HCl�����װ��D��ʢ���DZ���̼��������Һ��
�ʴ�Ϊ��ʯ��ʯ�������ʯ���״CaCO3��������NaHCO3��Һ����̼��������Һ����
������ܵ������Ƿ�ֹ������NH3�ж�����ֹNH3��Ⱦ�����������ˮ�Ȼ��Ƶ����������ն����NH3����ֹ��Ⱦ������
�ʴ�Ϊ�����ն����NH3��
������NH4Cl�����ֽ⣬����ͨ��������ٵ����жϲ���ĺ�������˲����ǣ�ȡ������������Թ��У����ȣ��������ʧ�����Թܿ��ڱ����н϶�Ĺ������ᡣ


 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ļ��㣺
��1���������Ķ�������������������ǵ����ʵ���֮��Ϊ____������������֮��Ϊ____��ͬ��ͬѹ�µ����֮��Ϊ_____��
��2��0.2mol HCl��������ˮ���200mL�����ᣬ����������ʵ���Ũ��Ϊ____���кʹ�ϡ���ᣬ��NaOH���������Ϊ____��
��3��ij��̬������Ļ�ѧʽΪRO2����״����0.88g������������Ϊ448mL������������Ħ������Ϊ_____��R�����ԭ������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1) ��������Ӧ�Ļ�ѧ����ʽ��__________��
��������Ӧ�Ļ�ѧ����ʽ��__________��
(2)д��������CH3(CH2)3CH3������ͬ���칹��Ľṹ��ʽ������(ϵͳ������)��
�ٽṹ��ʽ��_____________�����ƣ�_____________
�ڽṹ��ʽ��_____________�����ƣ�_____________��
(3)ijһ�ȴ�������������2������CH3����2������CH2������1���� ����1������Cl�������������������л��ﹲ���֣�д�����ǵĽṹ��ʽ��
����1������Cl�������������������л��ﹲ���֣�д�����ǵĽṹ��ʽ��![]() ��
�� ��_________��_________��
��_________��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˼ά�ǻ�ѧ�����г��õ�һ��˼ά�����������йط�Ӧ����ʽ��������ȷ����
��֪ | ���� | |
A | ��Fe����CuSO4��Һ��Fe��Cu2��===Cu��Fe2�� | ��Na���뵽CuSO4��Һ��2Na��Cu2��===Cu��2Na�� |
B | ϡ������Ba(OH)2��Һ��Ӧ��������2H����SO42-��Ba2����2OH��===BaSO4����2H2O | NaHSO4��Һ��Ba(OH)2��Һ��Ӧ������2H����SO42-��Ba2����2OH��===BaSO4����2H2O |
C | ����������Ӧ2Fe��3Cl2 | ���͵ⵥ�ʷ�Ӧ2Fe��3I2 |
D | ��Ca(ClO)2��Һ��ͨ������CO2��Ca2����2ClO����CO2��H2O===CaCO3����2HClO | ��Ca(ClO)2��Һ��ͨ������SO2��Ca2����2ClO����SO2��H2O===CaSO3����2HClO |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷���м(��Ҫ�ɷ�ΪFe��������C��S��P��)��ȡ��Ч��ˮ��K2FeO4������ͼ��

����˵������ȷ����
A. ����м������ǰ�����ȵĴ�����Һȥ����
B. ������ǽ�Fe2+ת��ΪFe(OH)3
C. ������з����ķ�Ӧ�����ӷ���ʽΪ2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. ������з�Ӧ�ܷ�����ԭ��������ͬ�����£�K2FeO4���ܽ��С��Na2FeO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ʾ��ȷ���� (����)
A. ��FeI2��Һ��ͨ�����������Cl2��2I ��=2Cl����2I2
B. ͭ��ϡ���ᷴӦ��3Cu��4H����2NO3��=3Cu2����2NO����2H2O
C. ����ʯ���ڴ����У�CaCO3��2H��=Ca2����H2O��CO2��
D. ��FeCl3����ˮ���ɽ��壺Fe3����3H2O![]() Fe(OH)3(����)��3H��
Fe(OH)3(����)��3H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶Ⱥ㶨�������£���2 L�ݻ�������ܱ������У�������Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g)����ʼ����4 mol��SO2��2 mol��O2��10 s��ﵽƽ��״̬����ʱc(SO3)=0.5 mol��L-1������˵������ȷ���� (����)
2SO3(g)����ʼ����4 mol��SO2��2 mol��O2��10 s��ﵽƽ��״̬����ʱc(SO3)=0.5 mol��L-1������˵������ȷ���� (����)
A.v(SO2)��v(O2)=2��1B.10 s�ڣ�v(SO3)=0.05 mol��L-1��s-1
C.SO2��ƽ��ת����Ϊ25%D.ƽ��ʱ�����ڵ�ѹǿ�Ƿ�Ӧǰ��5/6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A���������Ƿ��͵õ���Ҳ�ɴ���ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
��1����ȡA9.0g������ʹ�������������ܶ�����ͬ������H2��45������A����Է�������Ϊ��______��
��2������9.0gA��������O2���ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g����A�ķ���ʽΪ��________��
��3����ȡA9.0g����������NaHCO3��ĩ��Ӧ������2.24LCO2����״�������������������Ʒ�Ӧ������2.24LH2����״�������ýṹ��ʽ��ʾA�к��еĹ����ţ�______________________��
��4��A�ĺ˴Ź�����������ͼ����A�к���__________����ԭ�ӡ�
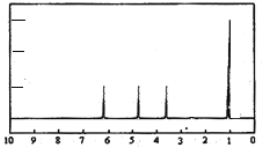
��5������������A�Ľṹ��ʽ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2 L���ܱ������з�����ӦxA(g)��yB(g)![]() zC(g)��ͼ�ױ�ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ�ұ�ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���ǣ� ��
zC(g)��ͼ�ױ�ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ�ұ�ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���ǣ� ��
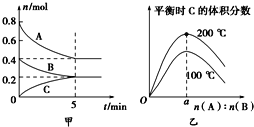
A. 200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v(B)��0.04 mol��L��1��min��1
B. 200��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ25
C. �����������200�潵�µ�100�棬ԭƽ��һ�����ƻ��������淴Ӧ���ʾ�����
D. ��ͼ�ҿ�֪����ӦxA(g)��yB(g)![]() zC(g)�ġ�H<0����a��2
zC(g)�ġ�H<0����a��2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com