
【题目】关于物质的量的计算:
(1)等质量的二氧化硫和三氧化硫,它们的物质的量之比为____,所含分子数之比为____,同温同压下的体积之比为_____。
(2)0.2mol HCl气体溶于水配成200mL的盐酸,此盐酸的物质的量浓度为____,中和此稀盐酸,需NaOH固体的质量为____。
(3)某气态氧化物的化学式为RO2,标准状况下0.88g该氧化物的体积为448mL,则该氧化物的摩尔质量为_____,R的相对原子质量为_____。
【答案】5:4 5:4 5:4 1mol·L-1 8g 44g·mol-1 12
【解析】
根据n=![]() =
=![]() =
=![]() 结合物质的构成解答该题.
结合物质的构成解答该题.
(1)已知M(SO2)=64g·mol-1,M(SO3)=80g·mol-1,设质量都为m g,等质量的二氧化硫和三氧化硫,它们的物质的量之比为n(SO2):n(SO3)=![]() =5:4;物质的量之比为等于所含分子数之比为:5:4;同温同压下的体积之比等于物质的量之比,为5:4;
=5:4;物质的量之比为等于所含分子数之比为:5:4;同温同压下的体积之比等于物质的量之比,为5:4;
(2)0.2molHCl气体溶于水配成200mL的盐酸,此盐酸的物质的量浓度C=![]() =
=![]() =1mol·L-1,中和此稀盐酸,需NaOH固体的质量为0.2mol×40g·mol-1=8.0g;
=1mol·L-1,中和此稀盐酸,需NaOH固体的质量为0.2mol×40g·mol-1=8.0g;
(3)8.8g该氧化物的体积为448mL,物质的量为![]() =0.02mol,故该物质的摩尔质量为
=0.02mol,故该物质的摩尔质量为![]() =44g·mol-1;该物质的相对分子质量为44,R元素的相对原子质量为44-16×2=12。
=44g·mol-1;该物质的相对分子质量为44,R元素的相对原子质量为44-16×2=12。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. Ba(HCO3)2溶液与少量的NaOH溶液反应:Ba2++HCO![]() +OH-=BaCO3↓+H2O
+OH-=BaCO3↓+H2O
B. 次氯酸钙溶液中通入过量的二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
C. 用氨水吸收少量二氧化硫 OH-+SO2=HSO3-
D. 硫酸与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
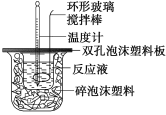
(1)烧杯间填满碎泡沫塑料的作用是_________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。
(5)倒入NaOH溶液的正确操作是 _________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中正确的是( )
A.在水中溶解性:Na2CO3>NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3
D.配成溶液后分别测定pH,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
化学式 | 电离常数 |
HClO | K = 3×10-8 |
H2CO3 | K1 = 4×10-7 K2 = 6×10-11 |
A. 向NaClO溶液中通少量CO2:CO2+NaClO+H2O===NaHCO3+HClO
B. 向NaClO溶液中通过量CO2:CO2+2NaClO+H2O===Na2CO3+2HClO
C. 向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O===2Cl-+2HClO+CO2↑
D. 向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2===Cl-+ClO-+2CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示实验合理的是
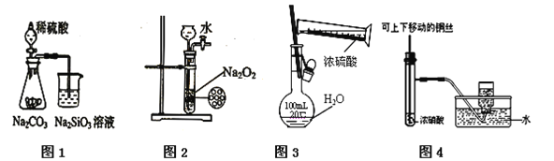
A. 图1为证明非金属性强弱:S > C > Si
B. 图2为制备少量氧气
C. 图3为配制一定物质的量浓度的硫酸溶液
D. 图4为制备并收集少量NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定体积的酸性KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.2000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为( )
A.0.0176B.0.1600C.0.1200D.0.2400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月国际期刊eLife上发表了浙江医科大学第二医院和浙江大学肿瘤研究的晁明和胡汛等人的一片论文,引发轰动。媒体以廉价的小苏打协助饿死了癌细胞予以报道。在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装 置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接______;_____接________;b接________(填接口编号)
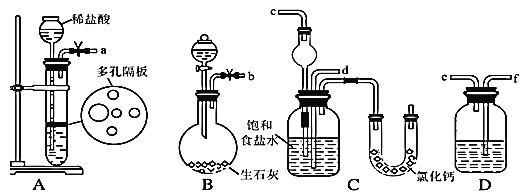
(2)检查A装置气密性的具体操作是___________。
(3)A中常选用的固体反应物为_________;D中应选用的液体为______。
(4)装有无水CaCl2的U形管的作用是 _______。
(5)第四步所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com