
【题目】下列说法正确的是
A.互称为同分异构体的物质不可能具有相同的通式
B.通式相同的不同有机物一定属于同系物
C.互为同分异构体的物质之问物理性质一定不同,但化学性质一定相似
D. 具有相同官能团的有机物不一定是同系物
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水等进行有效检测与合理处理。某工厂处理含+6价铬的污 水工艺的流程如下:

(1)请写出N2H4的电子式____________________。
(2)下列溶液中,可以代替上述流程中N2H4的是______________(填选项序号)。
A. FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D. Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为________________。
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为_______________________________。
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为___________________________。
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①己知含铬废水中存在着平衡,Cr2O72-和CrO42-在溶液中可相互转化,请用离子方程式表示它们之间的转化反应____________________________。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是 ( )
A. 乙醇与浓硫酸共热至170 ℃;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 乙醇与浓硫酸加热到140 ℃;由丙烯加溴制1,2-二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;溴乙烷与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】
维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体G的合成路线如下:
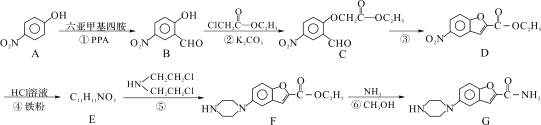
已知:![]()
请回答下列问题:
(1)C中含氧官能团的名称_________。(任写两种)
(2)反应④的反应类型是:_________,G的分子式为:_________。
(3)下列有关说法错误的是_________。
a.B遇FeCl3溶液显紫色且能发生银镜反应
b.A、B两种物质不可用核磁共振氢谱或红外光谱区别
c.C能发生取代、加成、氧化、还原反应
d.1 mol D能与2 mol NaOH反应
(4)反应②的化学方程式:_________;反应②加入K2CO3的作用是_________。
(5)写出同时满足下列条件B的一种同分异构体的结构简式:_________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③核磁共振氢谱有三组峰
(6)已知:![]()
请以甲苯、乙醇等为原料制备 ![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的O2时,三个反应中转移的电子数之比为
A.1:1:1 B.2:2:1 C.2:3:1 D.4:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
铁、铝、铜都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
![]()
①铜元素位于周期表_________区;Cu+的基态价电子排布图_________;NH4CuSO3中N、S、O三种元素的第一电离能由大到小的顺序为_________(元素符号表示)。
②SO42-中心原子的杂化方式为_________,SO32-的价层电子互斥模型为_________。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式_________。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是_________。
a.因NH3和H2O都为极性分子,且它们还存在分子内氢键,所以氨气极易溶于水
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_________。
(4)下图所示为金属铜的一个晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则晶胞中铜原子的配位数为_________,用含有a、ρ的代数式表示的阿伏加德罗常数为:_________ mol-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离四氯化碳和甲苯的混合物(两者互溶,沸点分别为76.75℃和110.6℃),可选用的分离方法为( )
A.萃取法
B.蒸馏法
C.结晶法
D.分液法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关方程式书写正确的是( )
A.醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O
B.H2S在水溶液中的电离:H2S+H2O![]() H3O++ HS-
H3O++ HS-
C.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+![]() I2+ 2H2O
I2+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的选项是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com