
【题目】利用化学原理对工厂排放的废水等进行有效检测与合理处理。某工厂处理含+6价铬的污 水工艺的流程如下:

(1)请写出N2H4的电子式____________________。
(2)下列溶液中,可以代替上述流程中N2H4的是______________(填选项序号)。
A. FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D. Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为________________。
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为_______________________________。
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为___________________________。
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①己知含铬废水中存在着平衡,Cr2O72-和CrO42-在溶液中可相互转化,请用离子方程式表示它们之间的转化反应____________________________。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为__________________________________。
【答案】 ![]() AD 2:3 Cr(OH)3+OH-=[Cr(OH)4]- 或Cr(OH)3+OH-=Cr- +2H2O 6.7×10-31 Cr2O72-+OH-=2CrO42-+2H+ BaCrO4
AD 2:3 Cr(OH)3+OH-=[Cr(OH)4]- 或Cr(OH)3+OH-=Cr- +2H2O 6.7×10-31 Cr2O72-+OH-=2CrO42-+2H+ BaCrO4
【解析】含Cr2O72-离子的废水加入N2H4溶液调节溶液pH=2-3,重铬酸根离子被还原为Cr3+离子,再加入氢氧化钠溶液控制溶液pH生成Cr(OH)3。
(1)N2H4的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)可以代替上述流程中N2H4溶液,需要具有还原性,能还原重铬酸根离子。A.FeSO4溶液中亚铁离子具有还原性,可以还原Cr2O72-离子,故A符合; B.浓HNO3溶液具有强氧化性,不能表现还原性,不能还原Cr2O72-,故B不符合;C.酸性KMnO4 是强氧化剂不能还原Cr2O72-,故C不符合;D.Na2SO3溶液中亚硫酸根离子具有还原性,可以还原Cr2O72-,故D符合;故答案为:AD;
(3)加入N2H4的流程中,N2H4转化为无污染的物质,即生成氮气和水,反应中N元素由-2价变成0价,化合价升高4,Cr元素化合价由+6价变成+3价,降低6,则该反应中氧化剂与还原剂的物质的量之比为4:6=2:3,故答案为:2:3;
(4)Cr(OH)3的化学性质与Al(OH)3相似。如果加入NaOH溶液时溶液的pH过高,Cr(OH)3将被氢氧化钠溶解,离子方程式为Cr(OH)3+OH-=CrO2- +2H2O,故答案为:Cr(OH)3+OH-=CrO2- +2H2O;
(5)阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Cr3++3NaR═3Na++CrR3,其中NaR为阳离子交换树脂,Mn+为要测定的离子Cr3+,Na+比交换前增加了4.6×10-2gL-1,物质的量浓度=![]() ×102mol/L=2×10-3mol/L,计算被交换的离子Cr3+浓度=
×102mol/L=2×10-3mol/L,计算被交换的离子Cr3+浓度=![]() ×2×10-3mol/L,Cr(OH)3(s)3c(OH-)+c(Cr3+),将pH=5的废水经过阳离子交换树脂后,溶液中c(OH-)=10-9mol/L,Ksp=c3(OH-)c(Cr3+)=[10-9]3×
×2×10-3mol/L,Cr(OH)3(s)3c(OH-)+c(Cr3+),将pH=5的废水经过阳离子交换树脂后,溶液中c(OH-)=10-9mol/L,Ksp=c3(OH-)c(Cr3+)=[10-9]3×![]() ×2×10-3mol/L=6.7×10-31,故答案为:6.7×10-31;
×2×10-3mol/L=6.7×10-31,故答案为:6.7×10-31;
(6)①Cr2O72-和CrO42-在溶液中相互转化,离子方程式为Cr2O72-+H2O![]() 2CrO42-+2H+,故答案为:Cr2O72-+H2O
2CrO42-+2H+,故答案为:Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
②含铬废水中存在着平衡:Cr2O72-+H2O2CrO42-+2H+.在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,氢氧根离子和氢离子反应生成水,促使平衡正向进行,有利于铬元素转化为铬酸钡沉淀,则生成沉淀的化学式为:BaCrO4;故答案为:BaCrO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
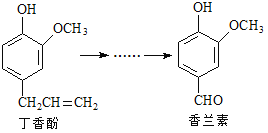
有关上述两种化合物的说法正确的是
A. 常温下1 mol丁香酚只能与1 mol Br2反应
B. 丁香酚不能与FeCl3溶液发生显色反应
C. 1 mol香兰素最多能与3 mol氯气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为__________________;
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_________________________;
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________;可循环使用的物质X是________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_______________________;
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、_______和_________;
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.58×10-9,请问至少需要______ mol·L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M被广泛用于医药、香料的合成,其一种合成路线如下(反应试剂与反应条件已省略):

已知A与B互为同分异构体。完成下列填空:
(1)写出M中含氧官能团的名称:__________。1mol D最多能与___________mol ![]() 发生加成反应。
发生加成反应。
(2)反应②所需试剂与条件是______________。反应③的反应类型是__________________。
(3)写出结构简式。A ___________________C _______________________
(4)写出检验D已完全转化为M的方法。___________________。
(5)写出两种符合下列要求的M的同分异构体的结构简式。 _____________
i. 苯环上的一氯代物只有两种 ii. 能发生水解反应 iii. 分子中含有两个甲基
(6)有人认为仅用反应①就能得到B,但事实证明产物中B的含量远远小于A,由此可以得到的结论是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1L的三个密闭容器中,分别放入铁粉并充入1mo1CO ,控制在不同温度下发生反应:![]() 当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
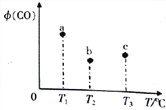
A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼( N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)0.5mol肼中含有__________ mol极性共价键。
(2) 肼的性质与氨气相似,易溶于水,有如下反应过程:
N2H4+H2O![]() N2H4·H2O
N2H4·H2O![]() N2H5++OH-
N2H5++OH-
①常温下,某浓度N2H5C1溶液的pH为5,则该溶液中由水电离产生的c(H+)为______mol/L。
②常温下,0.2mol/L N3H4溶液0.1mol/L HCL溶液等体积混合,混合溶液的pH>7,
则溶液中v(N2H5+)________v(N2H4·H2O)(填“>”、“<”或“=”)。
(3)工业上可用肼(N2H4)与新制Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为______________________________________。
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应成氮气与水蒸气。已知1.6g液态肼在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式___________________。
(5)肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池正极反应式为_______________,电池工作过程中,A极区溶液的pH____________(填“增大”“减小”或“不变”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )。
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-
A.①③ B.①②③ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取(NH4)2SO4和NH4HSO4混合物样品7.58g,加入含0.1mol NaOH的溶液,加热充分反应,生成NH3 1792mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.互称为同分异构体的物质不可能具有相同的通式
B.通式相同的不同有机物一定属于同系物
C.互为同分异构体的物质之问物理性质一定不同,但化学性质一定相似
D. 具有相同官能团的有机物不一定是同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com