
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 个
个![]() 胶体粒子的质量为78g
胶体粒子的质量为78g
B.![]() g
g![]() 和CuO的混合物中含有铜原子数为
和CuO的混合物中含有铜原子数为![]()
C.在![]() 的碳酸钠溶液中,阴离子总数一定大于
的碳酸钠溶液中,阴离子总数一定大于![]()
D.标准状况下,![]() L己烷中共价键数目为
L己烷中共价键数目为![]()
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3.有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | ________ |
② | ________ | ________ | 1 | 0.5a |
③ | m | g(g=4m) | 0 | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K、1.01×105 Pa,将22 g CO2通入0.75 L 1.0 mol·L-1NaOH溶液中充分反应,测得反应放出的热量为a kJ。已知该条件下1 mol CO2通入1 L 2.0 mol·L-1NaOH溶液中充分反应放出的热量为b kJ。则CO2与NaOH反应生成NaHCO3的热化学方程式为( )。
A. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
B. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
C. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
D. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18 ;Ksp(CuS)=1.3×10-36 ;Ksp(ZnS)=1.6×10-24 。下列关于常温时的有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的ZnSO4晶体加入到0.1 mol·L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23 mol·L-1
C. 除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂
D. 向饱和的FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)、Ksp(FeS)都变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+ CO2(g)![]() FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
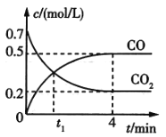
(1)t1min时,正、逆反应速率的大小关系为v正__v逆(填“>”“<”或“=”).
(2)0~4min内,CO2的转化率为__,CO的平均反应速率,v(CO)=__。
(3)下列条件的改变能减慢上述反应的反应速率的是__(填序号,下同)。
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是__。
①v(CO2)=v(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以铝铁质岩![]() 主要成分是
主要成分是![]() 、
、![]() 和
和![]() 为原料制备
为原料制备![]() 和粗硅,其流程如图所示:
和粗硅,其流程如图所示:
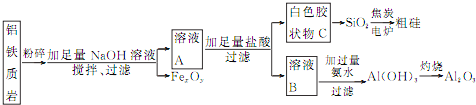
![]() 制备粗硅的化学方程式为 ______ 。
制备粗硅的化学方程式为 ______ 。
![]() 溶液B中加氨水生成
溶液B中加氨水生成![]() 的离子方程式为 ______,在空气中灼烧固体
的离子方程式为 ______,在空气中灼烧固体![]() 时,用到多种硅酸盐质仪器,除玻璃棒、酒精灯、泥三角外,还有 ______
时,用到多种硅酸盐质仪器,除玻璃棒、酒精灯、泥三角外,还有 ______ ![]() 填仪器名称
填仪器名称![]() 。
。
![]() 在高温下,氧化铝可以与氮气、碳反应,生成一种耐高温、抗冲击的氮化铝和一种有毒气体,该反应的化学方程式为 ______ ;该反应中每生成2mol氮化铝,
在高温下,氧化铝可以与氮气、碳反应,生成一种耐高温、抗冲击的氮化铝和一种有毒气体,该反应的化学方程式为 ______ ;该反应中每生成2mol氮化铝,![]() 得到电子的物质的量为 ______ mol。
得到电子的物质的量为 ______ mol。
![]() 某实验小组用CO还原法定量测定
某实验小组用CO还原法定量测定![]() 的组成,称取mg样品进行定量测定。
的组成,称取mg样品进行定量测定。
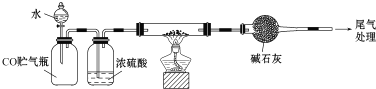
![]() 根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品, ______
根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品, ______ ![]() 请按正确顺序填入下列步骤的标号
请按正确顺序填入下列步骤的标号![]() 。
。
![]() 点燃酒精灯
点燃酒精灯![]() 打开分液漏斗活塞
打开分液漏斗活塞![]() 停止加热,充分冷却
停止加热,充分冷却 ![]() 关闭分液漏斗活塞
关闭分液漏斗活塞![]() 收集气体并检验纯度
收集气体并检验纯度
![]() 若实验中每步反应都进行完全,反应后样品质量减少了ng,则
若实验中每步反应都进行完全,反应后样品质量减少了ng,则![]() 中x:
中x:![]() ______
______ ![]() 若实验中
若实验中![]() 未被充分还原,则x:y的值 ______
未被充分还原,则x:y的值 ______ ![]() 填“偏大”“偏小”或“无影响”
填“偏大”“偏小”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,则此温度下反应①的平衡常数为
A. 9 mol2·L-2B. 12 mol2·L-2C. 16 mol2·L-2D. 20 mol2·L-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
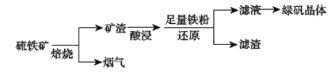
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式________。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
(3)滤液中金属阳离子的检验方法__________。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由________。(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
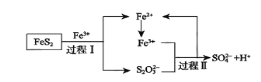
已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整______FeS2+______Fe3++_______ ______=7Fe2++______S2O32-+____ ______
②过程II反应的离子方程式________________________________________。
(6)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液b mL。反应原理:6Fe2++Cr2O72-+14H+ =6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为______________。(FeSO4·7H2O摩尔质量为278 g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-x FePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是

A. 放电时Li+从左边移向右边,PO43-从右边移向左边
B. 放电时,正极反应式为:Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时M极连接电源的负极,电极反应为6C+xe-=C6x-
D. 充电时电路中通过2.0mol电子,产生7.0gLi
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com