
【题目】25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18 ;Ksp(CuS)=1.3×10-36 ;Ksp(ZnS)=1.6×10-24 。下列关于常温时的有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的ZnSO4晶体加入到0.1 mol·L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23 mol·L-1
C. 除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂
D. 向饱和的FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)、Ksp(FeS)都变大
【答案】C
【解析】A、由于Ksp(CuS)=1.3×10-36<Ksp(ZnS)=1.6×10-24<Ksp(FeS)=6.3×10-18,所以溶解度CuS<ZnS<FeS,故A错误;B、原硫化钠溶液中硫离子最大浓度为:c(S2-)=0.1 mol/L,所以锌离子最小浓度为:c(Zn2+)=![]() mol/L=1.6×10-23mol/L,故B错误;C、由于Ksp(CuS)=1.3×10-36<Ksp(FeS)=6.3×10-18,硫化铜的溶解度小于硫化亚铁的,所以除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂,故C正确;D、向饱和的FeS 溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,温度不变,所以Ksp(FeS)不变,故D错误;故选C。
mol/L=1.6×10-23mol/L,故B错误;C、由于Ksp(CuS)=1.3×10-36<Ksp(FeS)=6.3×10-18,硫化铜的溶解度小于硫化亚铁的,所以除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂,故C正确;D、向饱和的FeS 溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,温度不变,所以Ksp(FeS)不变,故D错误;故选C。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2 , 所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p﹣CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p﹣CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
实验编号 | 实验目的 | T/K | pH | c/10﹣3molL﹣1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | ||||
③ | 298 | 10 | 6.0 | 0.30 | |
(2)[数据处理]实验测得p﹣CP的浓度随时间变化的关系如图.
请根据如图实验①曲线,计算降解反应在50﹣150s内的反应速率:v(p﹣CP)= .
(3)[解释与结论]实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: .
(4)实验③得出的结论是:pH等于10时, .
(5)根据题意:在一定条件下H2O2和Fe2+的离子反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的2L的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将生成物SO3通入过量BaCl2溶液中,得到沉淀的质量为233g
D. 达到平衡时,平衡常数为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________。
(2)丙溶液中存在的电离平衡为______________(用电离方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为__________________。
(4)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL 丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
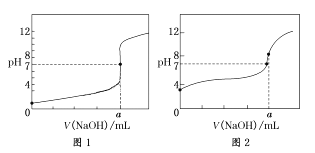
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=_______ mL,此时丙溶液中的质子守恒关系式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g) ![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ/mol。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
1/2N2(g)+CO2(g) ΔH=-373.4 kJ/mol。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
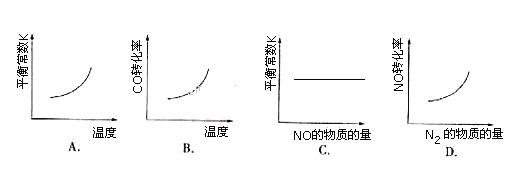
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A、B、C、D为短周期元素,且只有A、D为非金属元素.A的氢化物溶于水得到的溶液能使酚酞溶液变红.B、C、D的最高价氧化物对应水化物相互之间能够两两反应,且D原子最外层电子数是C原子最外层电子数的2倍.B、E元素同主族,且原子序数相差8.
(1)E在元素周期表中的位置: , 写出E的最高价氧化物对应水化物与C的单质反应的化学方程式: .
(2)A的氢化物溶于水后的电离方程式为;实验室制备A的氢化物的化学方程式为 .
(3)B单质在空气中燃烧后的产物为 , 产物中存在的化学键类型有 , 写出该产物和水反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是一种局部麻醉剂,可用于黏膜溃疡、创面等的镇痛,一般制成软膏或栓剂使用,它的工业合成有如下所示的两种途径。途径Ⅰ已被逐渐淘汰,现在使用较多的是途径Ⅱ。

已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
②苯胺(![]() )分子中的氨基易被氧化。
)分子中的氨基易被氧化。
请回答下列问题:
(1)化合物B的结构简式为________。
(2)反应⑦的化学方程式为______________________________________________。
(3)下列关于上述合成路线的说法正确的是________。
a.反应①除了主要生成A物质外,还可能生成 等;
等;
b.途径Ⅱ中的步骤①和⑤可以互换;
c.反应③的另一产物是H2O;
d.与途径Ⅱ相比,途径Ⅰ的缺点是步骤多,产率低;
e.途径Ⅰ中的步骤③的目的是保护氨基不被步骤④中的KMnO4酸性溶液氧化。
(4)途径Ⅱ中的步骤⑤和⑥能互换吗?________,理由是_______________________。
(5)苯佐卡因有多种同分异构体,其中有2个对位取代基,-NH2直接连在苯环上,分子结构中含有酯基的同分异构体有:
 、________、________。
、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、AlO ![]() 、SiO
、SiO ![]() 、SO
、SO ![]() 、CO
、CO ![]() 、SO
、SO ![]() 中的若干种离子.某同学对该溶液进行了如图所示实验:下列判断正确的是( )
中的若干种离子.某同学对该溶液进行了如图所示实验:下列判断正确的是( ) 
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO ![]() 和SiO
和SiO ![]() 一定存在于溶液X中
一定存在于溶液X中
D.CO ![]() 和SO
和SO ![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com