
【题目】将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-![]() 2Fe2++I2的是
2Fe2++I2的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①和③ B.②和④ C.③和④ D.①和②
【答案】A
【解析】将0.2molL-1的KI溶液和0.05molL-1Fe2(SO4)3溶液等体积混合后,若此反应不可逆,Fe3+恰好完全反应,I-过量,则溶液中无Fe3+,故只需要证明溶液中含Fe3+,则即能证明此反应为可逆反应,能建立化学平衡。①向溶液中滴入KSCN溶液,溶液变红,则说明溶液中有Fe3+,即能说明反应存在平衡,故①正确;②论反应存不存在平衡,溶液中含I-,向溶液中滴入AgNO3溶液均生成黄色沉淀,不能说明反应存在平衡,故②错误;③无论反应存不存在平衡,溶液中均存在Fe2+,滴入K3[Fe(CN)6]溶液均有蓝色沉淀生成,故③错误;④无论反应存不存在平衡,溶液中均有I2,滴入淀粉溶液后溶液均变蓝色,故不能证明存在平衡,故④错误;故选D。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A,B两元素形成的化合物可表示为( )
A.BA2
B.BA3
C.A3B2
D.B3A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如图:
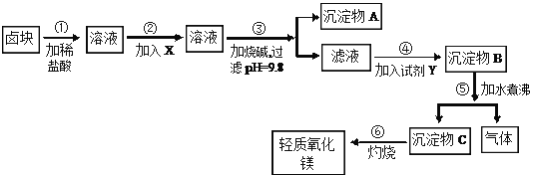
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH | 表2 化学试剂价格表 | ||||
物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
Fe(OH)3 | 2.7 | 3.7 | 漂液(含25.2% NaClO) | 450 | |
Fe(OH)2 | 7.6 | 9.6 | 双氧水(含30% H2O2) | 2400 | |
Mn(OH)2 | 8.3 | 9.8 | 烧碱(含98% NaOH) | 2100 | |
Mg(OH)2 | 10.0 | 11.1 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)在步骤②中加入的试剂X(从表2中选择)是_______而不是双氧水,其原因是_______________________。写出加入X发生反应的离子方程式_______________________。
(2)在步骤③中控制pH=9.8,其目的是____________________________。
(3)沉淀物A的成分为______________,试剂Y(从表2中选择)应该是_______。
(4)在步骤⑤中发生反应的化学方程式是________________________。
(5)若在实验室中完成步骤⑥,则沉淀物C必需在_______(填仪器名称)中灼烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( ) 
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.W对应的单质只可以跟强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故或药品的处理正确的是( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.当出现CO中毒时,应立即将中毒者抬到室外通风处
C.制取并收集氧气结束后,应立即停止加热
D.将含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)在⑤~⑨元素中,原子半径最小的是 , 其离子的原子结构示意图为 , 离子半径最大的是 .
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 .
(3)写出⑤和⑦的最高价氧化物对应水化物反应的离子方程式;
(4)按要求写出下列两种物质的电子式:②的氢化物;⑤的一种氧化物呈淡黄色,其含有的化学键类型有 , 电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置示意图如下:

回答下列问题:
(1)检查装置气密性的方法是______________________,a的名称是_____________________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式___________________________________。
(3)C的作用是________________________,D的作用是________________,是否可以把C和D的位置对调并说明理由_________________________________。
(4)写出E中发生反应的化学方程式_____________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
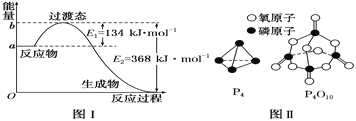
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O===O | P===O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作: A.转移到容量瓶中最终配制成250mL烧碱溶液;
B.用移液管(或碱式滴定管)量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为Mmol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL.
请完成下列问题:
(1)操作步骤的正确顺序是(填写字母)→→→→
(2)滴定至终点时,锥形瓶内溶液的pH约为 , 终点时溶液颜色变化是
(3)若酸式滴定管没有用标准H2SO4溶液润洗,会对测定结果有何影响(填“偏高”、“偏低”或“无影响”,其他操作均正确)
(4)该烧碱样品的纯度计算式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com