
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作: A.转移到容量瓶中最终配制成250mL烧碱溶液;
B.用移液管(或碱式滴定管)量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为Mmol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL.
请完成下列问题:
(1)操作步骤的正确顺序是(填写字母)→→→→
(2)滴定至终点时,锥形瓶内溶液的pH约为 , 终点时溶液颜色变化是
(3)若酸式滴定管没有用标准H2SO4溶液润洗,会对测定结果有何影响(填“偏高”、“偏低”或“无影响”,其他操作均正确)
(4)该烧碱样品的纯度计算式是 .
【答案】
(1)C;A;B;D;E
(2)4;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色
(3)偏高
(4)![]() ?%
?%
【解析】解:(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定, 所以答案是:C;A;B;D;E;(2)指示剂为甲基橙,变色范围为3.1﹣4.4,终点时pH约为4,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色,
所以答案是:4;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;(3)若酸式滴定管没有用标准H2SO4溶液润洗,相当于标准液被稀释,导致标准液浓度变小,用量变大,使测定结果偏高,
所以答案是:偏高;(4)滴到消耗的硫酸为:n(硫酸)=cV=(V2﹣V1)×10﹣3L×M mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2M(V2﹣V1)×10﹣3mol,
所以原来样品中氢氧化钠的物质的量为:2M(V2﹣V1)×10﹣3mol× ![]() =2M(V2﹣V1)×10﹣2mol,
=2M(V2﹣V1)×10﹣2mol,
则样品中氢氧化钠的质量为m(NaOH)=n(NaOH)×M(NaOH)=2M(V2﹣V1)×10﹣2 mol×40 g/mol=80M(V2﹣V1)×10﹣2 g,则该烧碱样品的纯度为: ![]() ×100%=
×100%= ![]() %,所以答案是:
%,所以答案是: ![]() %.
%.
【考点精析】本题主要考查了酸碱中和滴定的相关知识点,需要掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-![]() 2Fe2++I2的是
2Fe2++I2的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①和③ B.②和④ C.③和④ D.①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作错误的是
A.用药匙取用粉末状或小颗粒状固体B.用胶头滴管滴加少量液体
C.给盛有2/3体积液体的试管加热D.倾倒液体对试剂瓶标签面向手心
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1),请回答下列问题: 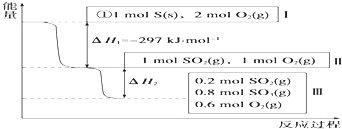
①写出能表示硫的燃烧热的热化学方程式: .
②在相同条件下,充入1mol SO3和0.5mol 的O2 , 则达到平衡时SO3的转化率为;此时该反应(填“放出”或“吸收”)KJ的能量.
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2 , 一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=molL﹣1min﹣1 . 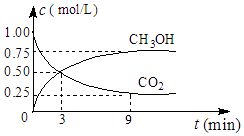
②能说明上述反应达到平衡状态的是(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2 , 同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数.下列说法正确的是
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2 , 达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
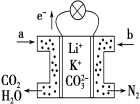
A.a为O2,b为CH4
B.CO 32-向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O 的反应中,被还原与被氧化的氯原子数之比是
A.6:1B.1:6C.5:1D.1:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com