
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
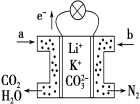
A.a为O2,b为CH4
B.CO 32-向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-=2CO32-
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)在⑤~⑨元素中,原子半径最小的是 , 其离子的原子结构示意图为 , 离子半径最大的是 .
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 .
(3)写出⑤和⑦的最高价氧化物对应水化物反应的离子方程式;
(4)按要求写出下列两种物质的电子式:②的氢化物;⑤的一种氧化物呈淡黄色,其含有的化学键类型有 , 电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为
Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2下列推断中正确的是
Fe(OH)2+2Ni(OH)2下列推断中正确的是
①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-==Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2 , 发生如下反应: ①2NO(g)+O2(g)2NO2(g)
②2NO2(g)N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )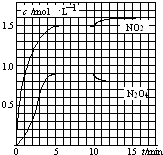
A.前5min反应的平均速率v(N2O4)=0.36mol(Lmin)﹣1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4 , T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作: A.转移到容量瓶中最终配制成250mL烧碱溶液;
B.用移液管(或碱式滴定管)量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为Mmol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL.
请完成下列问题:
(1)操作步骤的正确顺序是(填写字母)→→→→
(2)滴定至终点时,锥形瓶内溶液的pH约为 , 终点时溶液颜色变化是
(3)若酸式滴定管没有用标准H2SO4溶液润洗,会对测定结果有何影响(填“偏高”、“偏低”或“无影响”,其他操作均正确)
(4)该烧碱样品的纯度计算式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是( )
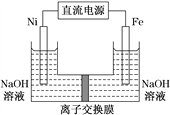
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2
B. 电解一段时间后,镍电极附近溶液的c(OH-)减小
C. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
D. 每制得1 mol Na2FeO4,理论上可以产生67.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
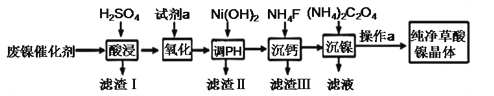
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向鸡蛋清的溶液中加入浓的硫酸铵溶液,蛋白质的性质发生改变并凝聚
B. 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,下层析出肥皂
C. 油脂为髙分子化合物,分子结构中都含有酯基
D. 纤维素、麦芽糖在一定条件下均可转化为葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com