
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2 , 发生如下反应: ①2NO(g)+O2(g)2NO2(g)
②2NO2(g)N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )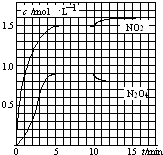
A.前5min反应的平均速率v(N2O4)=0.36mol(Lmin)﹣1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4 , T1℃达到平衡时,N2O4的转化率为10%
【答案】D
【解析】解:A、前5min反应的平均速率v(N2O4)= ![]() =
= ![]() =0.18mol(Lmin)﹣1 , 故A错误; B、T1℃时反应②的化学平衡常数K=
=0.18mol(Lmin)﹣1 , 故A错误; B、T1℃时反应②的化学平衡常数K= ![]() =
= ![]() =0.4L/mol,故B错误;
=0.4L/mol,故B错误;
C、在该题中,升高温度后,二氧化氮的浓度增加,四氧化二氮的浓度减小,所以平衡②逆向移动,该反应是放热的,故C错误;
D、若起始时向该容器中充入3.6mol NO2和2.0mol N2O4 , 则Qc=0.31<K,所以反应正向进行,T1℃达到平衡时,
2NO2(g) | N2O4(g) | ||
初始: | 1.8 | 1.0 | |
变化: | 2x | x | |
平衡: | 1.8﹣2x | 1.0+x |
则 ![]() =0.4,解得x=0.1,即N2O4的转化率为10%,故D正确.
=0.4,解得x=0.1,即N2O4的转化率为10%,故D正确.
故选D.
A、根据化学反应速率v= ![]() 来计算化学反应速率;
来计算化学反应速率;
B、化学平衡常数K= ![]() ,代入相关数据来计算即可;
,代入相关数据来计算即可;
C、根据温度对化学平衡移动的影响:升高温度,化学平衡向着吸热方向进行,反之向着放热方向进行,据此来判断反应的吸放热;
D、根据转化率= ![]() 来计算即可.
来计算即可.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】瑞典ASES公司设计的曾用于驱动潜艇的液氨﹣液氧燃料电池示意图如图所示,有关说法正确的是( ) 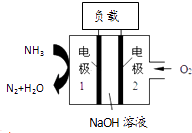
A.电极2发生氧化反应
B.电池工作时,Na+向负极移动
C.电流由电极1经外电路流向电极2
D.电极1发生的电极反应为:2NH3+6OH﹣﹣6e﹣=N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示酶和催化剂改变化学反应速率的原理,图2表示加入抑制剂对起始反应速率的影响。酶的抑制剂是与酶结合并降低酶活性的分子。竞争性抑制剂与底物竞争酶的活性部位,非竞争性抑制剂和酶活性部位以外的其他位点结合,从而抑制酶的活性。请回答下列问题。
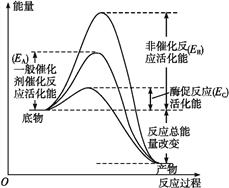 图1
图1 图2
图2
(1)由图1可知,该酶降低的活化能是______(用图中字母表示),与无机催化剂相比______________________,因而催化效率更高。
(2)活细胞产生酶的场所有________,需要的原料是________。
(3)图2中对照组是____曲线的结果,其中b为加入_____抑制剂的曲线,判断理由是_________________。请在图2中画出加入该酶的激活剂的曲线。________________
(4)信号肽假说认为,编码分泌蛋白的mRNA在翻译时首先合成的是N末端带有疏水氨基酸残基的信号肽,它被内质网膜上的受体识别并与之相结合。信号肽经由膜中蛋白质形成的孔道到达内质网内腔,但蛋白质转到高尔基体加工时却没有了该信号肽序列。据此我们可以推断内质网中可能存在的酶及作用是_______________。
(5)蛙的红细胞合成酶所需要的ATP主要由_______(过程)产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.保持体积不变,增加H2O(g)的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入Ar使压强增大
D.保持压强不变,充入Ar使体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
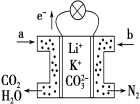
A.a为O2,b为CH4
B.CO 32-向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答,下列说法不正确的是( )
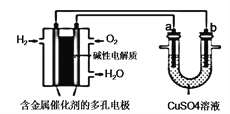
A. 此装置用于电镀铜时,电解一段时间,理论上硫酸铜溶液的浓度不变
B. 若a为粗铜,b为纯铜,该装置可用于粗铜的电解精炼
C. 燃料电池中负极反应为2H2-4e-+4OH- = 4H2O
D. 上述装置在工作过程中Cu2+ 向a电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) +Y(g)![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A. 反应前2min的平均速率v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com