
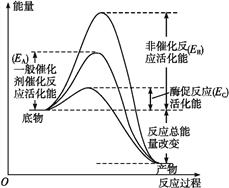
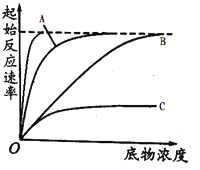
����Ŀ��ͼ1��ʾø�ʹ����ı仯ѧ��Ӧ���ʵ�ԭ��,ͼ2��ʾ�������Ƽ�����ʼ��Ӧ���ʵ�Ӱ�졣ø�����Ƽ�����ø��ϲ�����ø���Եķ��ӡ����������Ƽ�����ᄎ��ø�Ļ��Բ�λ,�Ǿ��������Ƽ���ø���Բ�λ���������λ����,�Ӷ�����ø�Ļ��ԡ���ش��������⡣
 ͼ1
ͼ1 ͼ2
ͼ2
(1)��ͼ1��֪,��ø���͵Ļ����______(��ͼ����ĸ��ʾ),�����������______________________,�����Ч�ʸ��ߡ�
(2)��ϸ������ø�ij�����________,��Ҫ��ԭ����________��
(3)ͼ2�ж�������____���ߵĽ��,����bΪ����_____���Ƽ�������,�ж�������_________________������ͼ2�л��������ø�ļ���������ߡ�________________
(4)�ź��ļ�˵��Ϊ,������ڵ���mRNA�ڷ���ʱ���Ⱥϳɵ���Nĩ�˴�����ˮ������л����ź���,����������Ĥ�ϵ�����ʶ����֮���ϡ��ź��ľ���Ĥ�е������γɵĿ�������������ǻ,��������ת���߶�����ӹ�ʱȴû���˸��ź������С��ݴ����ǿ����ƶ��������п��ܴ��ڵ�ø��������_______________��
(5)�ܵĺ�ϸ���ϳ�ø����Ҫ��ATP��Ҫ��_______(����)������
���𰸡���1��EB-EC ���ͻ�ܵ����ø�����
��2��ϸ���˻������ ���Ǻ��������
��3��A ������ �����Ũ�ȵ����ӣ������Ƽ���ϵ�ø�ı���ԽС�����������������ӽ����������Ӧ�ٶ�
��4�������е���ø�����ź�����ȥ
��5����������
�����������������
��1��������ͼ��֪����ø���Ļ�ѧ��Ӧ����Ҫ�Ļ��ΪEB����ø�ٷ�Ӧ�Ļ��ΪEC�����ø���͵Ļ��ΪEB-EC����һ��������Ļ�ѧ��Ӧ�����ȣ�ø���ͻ�ܵ����ø�������
��2������ø�Ļ�ѧ�����ǵ����ʻ�RNA����������Ϊ�������ϸ���ˣ������ʵĻ�����λΪ�����ᣬRNA�Ļ�����λΪ���Ǻ����ᣬ��˺ϳ�ԭ��Ϊ���Ǻ�������ᡣ
��3������ͼ�ұ�ʾ�������Ƽ�����ʼ��Ӧ���ʵ�Ӱ�죬��A����Ϊû�������Ƽ��ķ�Ӧ�������ߣ�Ϊ�����飬BCΪ�������Ƽ���Ӧ�������ߣ���������B�������Ũ�ȵ����ӣ�ø�ٷ�Ӧ�������ӣ�˵��BΪ���������Ƽ���������Ũ�Ƚϴ�ʱ�������Ƽ���ϵ�ø�ı�����С�����������������ӽ����������Ӧ���ʣ�����ø�ļ�����ﵽ���Ӧ��������Ҫ��ʱ���̣������Ӧ���ʲ��䣬���Ի��������𰸡�
��4���������⣬�ź��ľ���Ĥ�е������γɵĿ�������������ǻ����������ת���߶�����ӹ�ʱȴû���˸��ź������У�˵�������������е���ø�����ź�����ȥ��
��5�������ܵĺ�ϸ����ϸ���˺�ϸ������ATP����Ҫ��Դ������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������з�Ӧ���Խ�����ת��Ϊ���ȴ�99.9%�ĸߴ�����
��Ӧһ��Ni(�֣�s)+4CO(g)![]() Ni(CO)4(g) ��H<0
Ni(CO)4(g) ��H<0
��Ӧ����Ni(CO)4(g)![]() Ni(����s)+4CO(g)����H>0
Ni(����s)+4CO(g)����H>0
����˵���������(����)
A. ���ڷ�Ӧһ���ʵ�����ѹǿ��������Ni(CO)4������
B. �ᴿ�����У�CO�����ѭ��ʹ��
C. �����¶ȣ���Ӧһ�ķ�Ӧ���ʼ�С����Ӧ���ķ�Ӧ��������
D. ���ڷ�Ӧ������180��200�棬�¶�Խ�ߣ�Ni(CO)4(g)��ת����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1�� ��һ�������½�CO2 ��H2ת��Ϊ�״�������ˮ��������ط�Ӧ����
CO2(g) +H2(g)![]() CO(g)+H2O(g) ��H1=+41KJ/mol
CO(g)+H2O(g) ��H1=+41KJ/mol
CO(g) +2H2(g)![]() CH3OH(g) ��H2=-90KJ/mol
CH3OH(g) ��H2=-90KJ/mol
����CO2��H2ת��Ϊ�״�������ˮ�������Ȼ�ѧ����ʽΪ_____________________________________��
��2����һ���¶��£���2L�̶��ݻ����ܱ�������ͨ��2molCO2��3molH2��������ӦCO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H3<0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g) +H2O(g) ��H3<0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
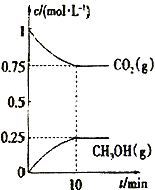
����˵���÷�Ӧ�Ѵ�ƽ��״̬����________________________��
A.��λʱ������3n molH-H�����ѣ�ͬʱ����2n mol O-H������
B.���������ܶȲ���ʱ��仯
C.��ϵ��n(CO2)/n(H2)=1��1���ұ��ֲ���
D. CO2����������ڻ�������б��ֲ���
�����д�ʩ��ʹn(CH3OH)/n(CO2)�������_______________��
A.�����¶� B.���º����£��ٳ���2molCO2��3molH2
C.ʹ�ø�Ч���� D.���º��ݳ���Heʹ��ϵѹǿ����
�ۼ�����¶��´˷�Ӧ��ƽ�ⳣ��K=_________������3λ��Ч���֣�����ʹK��ֵ��Ϊ1����Ӧ��ȡ�Ĵ�ʩ��___________________________��
A.����ѹǿ B.��ѹ����һ����H2 C. �����¶� D. �����¶�
��3����CO2��������Na2CO3��Һ����100mL 0.1mol/LNa2CO3��Һ��ȫ��0.44gCO2���壨��Һ����仯��������������Һ��c(HCO3-)+c(CO32-)+c(H2CO3)=________ mol/L
��4������Ϊ�ı�δ�������ʮ��Ƽ�֮һ��ȼ�ϵ����һ�����͵�����Ⱦ������������Ч�ʵ����������ͷ����豸�������Ʋ��ɵ�֮�Ƽ���������ҵ�͵�����ҵ��д���״�ȼ�ϵ�ؼ��Ե��������Ϊ���������ҺΪKOH ��Һ���ĸ����缫��Ӧ��___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������֮Դ�������йء�ˮ��˵������ȷ����
A. ˫��ˮ����Ϊ��ɫ������������Ϊ�仹ԭ����ΪO2���Ի���û����Ⱦ
B. ��ˮ��Ũ�����Ũ���ᰴ�����1�U3��ɵĻ��������ܽ�Au��Pt
C. �������ó�����ǿ�����Կɽ�����������ˮ��������
D. ������ָpH��7����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���طŵ硢���ʱ�ķ�ӦΪ
Fe��Ni2O3��3H2O![]() Fe��OH��2��2Ni��OH��2�����ƶ�����ȷ����
Fe��OH��2��2Ni��OH��2�����ƶ�����ȷ����
���ŵ�ʱ��FeΪ������Ni2O3Ϊ����
�����ʱ�������ϵĵ缫��Ӧʽ��Fe��OH��2��2e��==Fe��2OH��
�����ʱ��Ni��OH��2Ϊ����
�����صĵ缫�����ǽ���ij�ּ��Ե������Һ��
A. �٢ڢ� B. �٢ڢ� C. �٢ۢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ�м�������ᾧ�壬�ָ������£������Һ��pHΪ2�����жԸ���Һ�������в���ȷ���ǣ� ��
A.������Һ��Ũ��Ϊ0.01mol/L
B.��ˮ���������H+��Ũ����1.0��10��12 mol/L
C.�����ᾧ��ļ���������ˮ�ĵ���
D.���¶��¼�������pHΪ12��NaOH��Һ��ʹ����Һǡ�ó�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������г���7.6mol NO��3.8mol O2 �� �������·�Ӧ�� ��2NO��g��+O2��g��2NO2��g��
��2NO2��g��N2O4��g��
���NO2��N2O4��Ũ�ȱ仯��ͼ��ʾ��0��10minά�������¶�ΪT1�棬10min�����߲�ά���������¶�ΪT2�森����˵����ȷ���ǣ� ��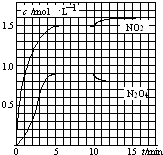
A.ǰ5min��Ӧ��ƽ������v��N2O4��=0.36mol��Lmin����1
B.T1��ʱ��Ӧ�ڵĻ�ѧƽ�ⳣ��K=0.6
C.��Ӧ�١��ھ�Ϊ���ȷ�Ӧ
D.����ʼʱ��������г���3.6mol NO2��2.0mol N2O4 �� T1��ﵽƽ��ʱ��N2O4��ת����Ϊ10%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;������(Ni)�������缫���ŨNaOH��Һ�Ʊ���������(Na2FeO4)��װ����ͼ��ʾ������˵����ȷ����( )
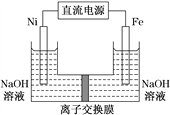
A. �����������缫��ӦΪFe��2e����2OH��===Fe(OH)2
B. ���һ��ʱ������缫������Һ��c(OH-)��С
C. �����ӽ���ĤΪ�����ӽ���Ĥ����������������Һ�к���FeO![]()
D. ÿ�Ƶ�1 mol Na2FeO4�������Ͽ��Բ���67.2 L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ������������������·���ȡ����Ӧ�õ����л�������5��
B. �����л��е�������ϩ����ͨ����������ϩ�����������ӳɷ�Ӧ����ȥ��ϩ
C. ��ϩ����Ȳ����ʹ��ˮ��ɫ������ͨ��ȼ������IJ�ͬ����������
D. �����ᡢ��������һ�������¶��ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com