
【题目】利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g)![]() Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
反应二:Ni(CO)4(g)![]() Ni(纯,s)+4CO(g) ΔH>0
Ni(纯,s)+4CO(g) ΔH>0
下列说法错误的是( )
A. 对于反应一,适当增大压强,有利于Ni(CO)4的生成
B. 提纯过程中,CO气体可循环使用
C. 升高温度,反应一的反应速率减小,反应二的反应速率增大
D. 对于反应二,在180~200℃,温度越高,Ni(CO)4(g)的转化率越高
科目:高中化学 来源: 题型:
【题目】芳香脂I(![]() )是一种重要的香料,工业上合成它的一种路线如下图所示。其中A的结构简式为
)是一种重要的香料,工业上合成它的一种路线如下图所示。其中A的结构简式为![]() ,C是能使溴的CCl4溶液褪色的烃,F是分子中含有一个氧原子的烃的衍生物。
,C是能使溴的CCl4溶液褪色的烃,F是分子中含有一个氧原子的烃的衍生物。
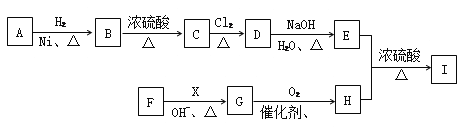
已知:①![]() ;
;
②酯环化合物:分子中含有3个及以上碳原子连接成的碳环,环内两个相邻碳原子之间可以是单键、双键或三键,环的数目可以是一个或多个。
(1)F的相对分子质量大于X,则F的名称为___________,X的结构简式为____________,C→D的另一种产物是HCl,则该反应的反应类型为_________________。
(2)从官能团角度上看,A属于_______物质,能将A、B区别开的试剂是_______,I中的官能团名称为________________________。
(3)写出D→E的化学方程式:_______________________________________________。
(4)B还有多种同分异构体,满足下列条件的同分异构体共有________种(不考虑立体异
构),其中核磁共振氢谱有4组峰,且峰面积之比为1:1: 2: 6的物质的结构简式为_______(任写一种)。
①能发生酯化反应 ②属于脂环化合物
(5)已知: ![]() (硝酸乙酯)。请写出以
(硝酸乙酯)。请写出以![]() 为基本原料合成三硝酸甘油酯的合成路线图(无机试剂任选):________________________________________________________。
为基本原料合成三硝酸甘油酯的合成路线图(无机试剂任选):________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2+ O2![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸的叙述中正确的是
A. 将水沿着玻璃棒慢慢地注入盛有浓硫酸的量筒中稀释,并不断搅拌
B. 运输时可以将浓硫酸密封装在铁罐中
C. 浓硫酸滴到硫酸铜晶体中的现象体现了浓硫酸的脱水性
D. 少量浓硫酸滴入紫色石蕊溶液中,溶液会褪为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了列车客运安全,下列药品从化学性质判断,由于易燃易爆而不能带上列车的是( )
①NH4NO3 ②(NH4)2SO4 ③KCl ④油漆 ⑤汽油 ⑥过磷酸钙 ⑦MgO
A.③④⑤⑥⑦B.①②⑦
C.①④⑤D.①④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的容器中进行反应:2HIH2+I2(正反应为吸热反应),反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需时间为( )
A.等于10 s
B.等于12 s
C.大于12 s
D.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典ASES公司设计的曾用于驱动潜艇的液氨﹣液氧燃料电池示意图如图所示,有关说法正确的是( ) 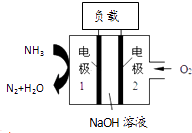
A.电极2发生氧化反应
B.电池工作时,Na+向负极移动
C.电流由电极1经外电路流向电极2
D.电极1发生的电极反应为:2NH3+6OH﹣﹣6e﹣=N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的转化在实际工业生产、生活中具有重要的意义。
(1)已知工业上合成氨N2(g)+3H2(g)![]() 2NH3(g)的能量变化如图所示,在一定温度下,向2 L的恒容密闭容器中投入2.2 mol N2和2.6 mol H2,经10 min达到平衡,测得以氢气表示的平均速率为0.03mol·L-1·min-1
2NH3(g)的能量变化如图所示,在一定温度下,向2 L的恒容密闭容器中投入2.2 mol N2和2.6 mol H2,经10 min达到平衡,测得以氢气表示的平均速率为0.03mol·L-1·min-1
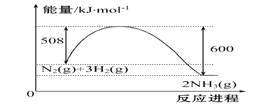
①该反应的热效应△H=______________
②反应达到平衡后放出的热量为__________kJ,此时N2的转化率为___________;在该温度下,反应的平衡常数K=__________
(2)利用炽热的活性炭可以处理NO2,反应原理为2C(s)+2NO2(g)![]() 2CO2(g)+N2(g),一定温度下,将一定量的活性炭和NO2加入一恒容密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填序号)。
2CO2(g)+N2(g),一定温度下,将一定量的活性炭和NO2加入一恒容密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填序号)。
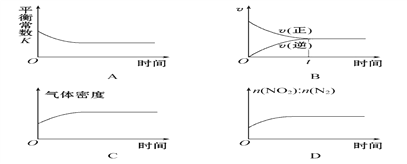
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示酶和催化剂改变化学反应速率的原理,图2表示加入抑制剂对起始反应速率的影响。酶的抑制剂是与酶结合并降低酶活性的分子。竞争性抑制剂与底物竞争酶的活性部位,非竞争性抑制剂和酶活性部位以外的其他位点结合,从而抑制酶的活性。请回答下列问题。
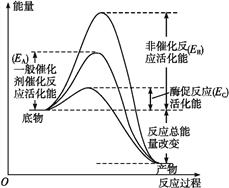 图1
图1 图2
图2
(1)由图1可知,该酶降低的活化能是______(用图中字母表示),与无机催化剂相比______________________,因而催化效率更高。
(2)活细胞产生酶的场所有________,需要的原料是________。
(3)图2中对照组是____曲线的结果,其中b为加入_____抑制剂的曲线,判断理由是_________________。请在图2中画出加入该酶的激活剂的曲线。________________
(4)信号肽假说认为,编码分泌蛋白的mRNA在翻译时首先合成的是N末端带有疏水氨基酸残基的信号肽,它被内质网膜上的受体识别并与之相结合。信号肽经由膜中蛋白质形成的孔道到达内质网内腔,但蛋白质转到高尔基体加工时却没有了该信号肽序列。据此我们可以推断内质网中可能存在的酶及作用是_______________。
(5)蛙的红细胞合成酶所需要的ATP主要由_______(过程)产生。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com