
【题目】水是生命之源,下列有关“水”说法中正确的是
A. 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染
B. 王水是浓盐酸和浓硝酸按体积比1︰3配成的混合物,可以溶解Au、Pt
C. 人们利用臭氧的强氧化性可将其用作自来水的消毒剂
D. 酸雨是指pH﹤7的雨水
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸的叙述中正确的是
A. 将水沿着玻璃棒慢慢地注入盛有浓硫酸的量筒中稀释,并不断搅拌
B. 运输时可以将浓硫酸密封装在铁罐中
C. 浓硫酸滴到硫酸铜晶体中的现象体现了浓硫酸的脱水性
D. 少量浓硫酸滴入紫色石蕊溶液中,溶液会褪为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的转化在实际工业生产、生活中具有重要的意义。
(1)已知工业上合成氨N2(g)+3H2(g)![]() 2NH3(g)的能量变化如图所示,在一定温度下,向2 L的恒容密闭容器中投入2.2 mol N2和2.6 mol H2,经10 min达到平衡,测得以氢气表示的平均速率为0.03mol·L-1·min-1
2NH3(g)的能量变化如图所示,在一定温度下,向2 L的恒容密闭容器中投入2.2 mol N2和2.6 mol H2,经10 min达到平衡,测得以氢气表示的平均速率为0.03mol·L-1·min-1
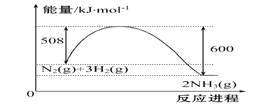
①该反应的热效应△H=______________
②反应达到平衡后放出的热量为__________kJ,此时N2的转化率为___________;在该温度下,反应的平衡常数K=__________
(2)利用炽热的活性炭可以处理NO2,反应原理为2C(s)+2NO2(g)![]() 2CO2(g)+N2(g),一定温度下,将一定量的活性炭和NO2加入一恒容密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填序号)。
2CO2(g)+N2(g),一定温度下,将一定量的活性炭和NO2加入一恒容密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填序号)。
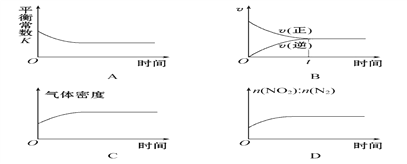
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是( ) ①C(s)+O2(g)═CO2(g);△H1 C(s)+ ![]() O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ ![]() O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8 .
A.①
B.④
C.②③④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
2 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
3 | 1.0 | a | 3.0 | 2.0 | 5.6 |
4 | |||||
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理________________________________________。
(2)a=______,设计实验2、3的目的是______________________
(3)利用实验2中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该同学绘制图1的依据是________________________________________
②该小组同学提出的假设是_________________________________________
③请你帮助该小组同学完成实验方案,并填写表中空白。
实 验 编 号 | 室温下,试管中所加试剂及其用量/mL | 再向试 管中加 入少量 固体 | 室温下 溶液颜 色褪至 无色所 需时间 /min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
④若该小组同学提出的假设成立,则其依据是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示酶和催化剂改变化学反应速率的原理,图2表示加入抑制剂对起始反应速率的影响。酶的抑制剂是与酶结合并降低酶活性的分子。竞争性抑制剂与底物竞争酶的活性部位,非竞争性抑制剂和酶活性部位以外的其他位点结合,从而抑制酶的活性。请回答下列问题。
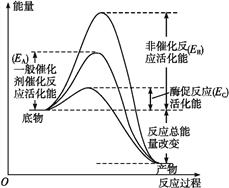 图1
图1 图2
图2
(1)由图1可知,该酶降低的活化能是______(用图中字母表示),与无机催化剂相比______________________,因而催化效率更高。
(2)活细胞产生酶的场所有________,需要的原料是________。
(3)图2中对照组是____曲线的结果,其中b为加入_____抑制剂的曲线,判断理由是_________________。请在图2中画出加入该酶的激活剂的曲线。________________
(4)信号肽假说认为,编码分泌蛋白的mRNA在翻译时首先合成的是N末端带有疏水氨基酸残基的信号肽,它被内质网膜上的受体识别并与之相结合。信号肽经由膜中蛋白质形成的孔道到达内质网内腔,但蛋白质转到高尔基体加工时却没有了该信号肽序列。据此我们可以推断内质网中可能存在的酶及作用是_______________。
(5)蛙的红细胞合成酶所需要的ATP主要由_______(过程)产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.保持体积不变,增加H2O(g)的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入Ar使压强增大
D.保持压强不变,充入Ar使体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是
A. 石油分馏是物理变化,可获得汽油、煤油、柴油等产品
B. C4H9Cl、C4H8Cl2的同分异构体种类分别有4种、9种(不含立体异构)
C. 淀粉和纤维素水解的最终产物不同
D. 由乙酸生成乙酸乙酯属于取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com