
【题目】不溶于水且比水轻的一组液体是( )
A.甲苯、四氯化碳
B.硝基苯、二氯甲烷
C.己烯、苯
D.酒精、溴
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
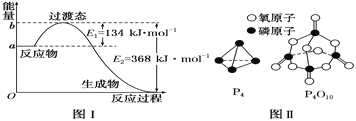
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O===O | P===O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作: A.转移到容量瓶中最终配制成250mL烧碱溶液;
B.用移液管(或碱式滴定管)量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为Mmol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL.
请完成下列问题:
(1)操作步骤的正确顺序是(填写字母)→→→→
(2)滴定至终点时,锥形瓶内溶液的pH约为 , 终点时溶液颜色变化是
(3)若酸式滴定管没有用标准H2SO4溶液润洗,会对测定结果有何影响(填“偏高”、“偏低”或“无影响”,其他操作均正确)
(4)该烧碱样品的纯度计算式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
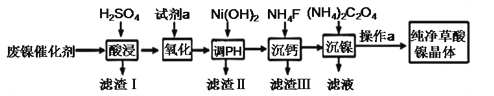
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
B. 1mol该有机物与NaOH溶液反应,最多消耗3mol NaOH
C. 分枝酸的分子式为C10H8O6
D. 分枝酸分子中含有2种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:aX(g)+bY(g)cZ(g)+d W(g).反应达平衡后保持温度不变,将气体体积压缩到原来的 ![]() ,当再次达平衡时,W的浓度为原平衡时的1.8倍.下列叙述中不正确的是( )
,当再次达平衡时,W的浓度为原平衡时的1.8倍.下列叙述中不正确的是( )
A.平衡向逆反应方向移动
B.a+b<c+d
C.Z的体积分数增加
D.X的转化率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“洁净煤技术”研究在世界上相当普遍.
(1)科研人员通过向地下煤层(焦炭)气化炉中鼓入水蒸气的方法,连续产出了高热值 的煤炭气,其主要成分是CO和H2 .
已知:H2(g)+ ![]() O2(g)═H2O(g)△H1=﹣241.8kJmol﹣1
O2(g)═H2O(g)△H1=﹣241.8kJmol﹣1
C(s)+ ![]() O2(g)═CO(g)△H2=﹣110.5kJmol﹣1
O2(g)═CO(g)△H2=﹣110.5kJmol﹣1
则生产煤炭气的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)CH3OH(g). 在2L密闭容器中充有10mol CO与20mol H2 , CO的平衡转化率与温度、压强的关系如图所示.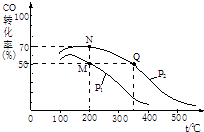
①关于上述反应在化学平衡状态时的描述正确的是 .
A.CO的含量保持不变
B.v正(CO)=v正(CH3OH)
C.容器中混合气体的平均相对分子质量保持不变
②该图像中P1P2(填“>”、“=”或“<”);
该反应逆反应的△H0 (填“>”、“=”或“<”).
③该反应的化学平衡常数表达式为K= , M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 .
④M,N两点平衡状态下,容器中总物质的量之比为:n(M)总:n(N)总= .
(3)已知在常温常压下: ①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A和芳香烃D为原料合成化合物X的路线如图所示:
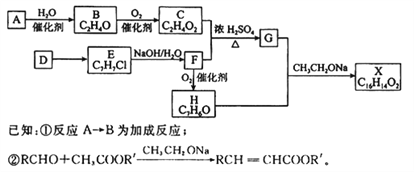
回答下列问题:
(1)A中含有官能团的名称是_______,F的名称是__________。
(2)E生成F的反应类型是___________。
(3)反应C+F→G的化学方程式为_______________________________。
(4)反应F→H的化学方程式为_________________________________。
(5)X的结构简式为________________,下列有关X的说法不正确的是________(填字母)
a.能发生水解反应 b.能发生银镜反应
c.不能使溴的四氯化碳溶液褪色 d.能与浓硝酸发生取代反应
(6)芳香族化合物M是G的同分异构体,M能与NaHCO3溶液反应产生气体,其中核磁共振氢谱有4组峰且峰面积之比为6:2:1:1的是___或____(填结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com