
����Ŀ������������
��1�����£��ݻ�Ϊ1L���������£�����Է�������ת�����䷴Ӧ���̺�������ϵ��ͼ��ʾ����֪��2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1������ش��������⣺ 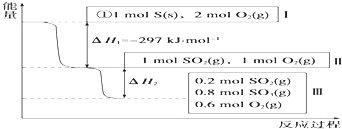
��д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
������ͬ�����£�����1mol SO3��0.5mol ��O2 �� ��ﵽƽ��ʱSO3��ת����Ϊ����ʱ�÷�Ӧ����ų��������ա���KJ��������
��2����CO2��ת�����л���ʵ��̼ѭ���������Ϊ1L���ܱ������У�����1molCO2��3molH2 �� һ�������·�Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.0kJmol��1 �� ���CO2��CH3OH��g��Ũ����ʱ��仯��ͼ��ʾ����3min��9min��v��H2��=molL��1min��1 �� 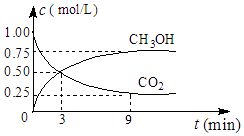
����˵��������Ӧ�ﵽƽ��״̬���������ţ���
A����Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1��1����ͼ�н���㣩
B�����������ܶȲ���ʱ��ı仯���仯
C����λʱ��������3mol H2 �� ͬʱ����1mol H2O
D��CO2����������ڻ�������б��ֲ���
��3����ҵ�ϣ�CH3OHҲ����CO��H2�ϳɣ��ο��ϳɷ�ӦCO��g��+2H2��g��CH3OH��g����ƽ�ⳣ��������˵����ȷ����
�¶�/�� | 0 | 100 | 200 | 300 | 400 |
ƽ�ⳣ�� | 667 | 13 | 1.9��10��2 | 2.4��10��4 | 1��10��5 |
A.�÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ
B.�÷�Ӧ�ڵ����²����Է����У������¿��Է����У�˵���÷�Ӧ��S��0
C.��T��ʱ��1L�ܱ������У�Ͷ��0.1mol CO��0.2mol H2 �� �ﵽƽ��ʱ��COת����Ϊ50%�����ʱ��ƽ�ⳣ��Ϊ100
D.��ҵ�ϲ����Ըߵ�ѹǿ��5MPa����250�棬����Ϊ�������£�ԭ����ת������ߣ�
���𰸡�
��1��S��s��+O2��g���TSO2��g����H=��297 KJ?mol��1��20%�����գ�19.66
��2��0.125��D
��3��ABC
���������⣺��1��ȼ������ָ1mol��ȼ����ȫȼ�������ȶ���������ų������������ԣ�������ʵ���Ϊ1mol����ͼ1��֪1molS��s����ȫȼ�շų�������Ϊ297KJ�����ԣ����ȼ���ȵ��Ȼ�ѧ����ʽS��s��+O2��g���TSO2��g����H=��297 KJmol��1�� ���Դ��ǣ�S��s��+O2��g���TSO2��g����H=��297 KJmol��1����2������ͼ����������Ϣ��֪����Ӧ2SO2��g��+O2��g��2SO3��g����ƽ�ⳣ��K= ![]() =
= ![]() =
= ![]() ������ͬ�����£�����1molSO3��0.5molO2 �� �跴Ӧ�ﵽƽ��ʱSO3ת����Xmol�����У�
������ͬ�����£�����1molSO3��0.5molO2 �� �跴Ӧ�ﵽƽ��ʱSO3ת����Xmol�����У�
2SO2��g��+ | O2��g�� | 2SO3��g�� | ||
��ʼ�� | 0 | 0.5mol/L | 1mol/L | |
�仯�� | Xmol/L | 0.5mol/L | Xmol/L | |
ƽ�⣺ | Xmol/L | ��0.5+0.5X��mol/L | ��1��X��mol/L |
�����¶Ȳ��䣬ƽ�ⳣ��K��ֵ�����֪��K= ![]() =
= ![]() ��ã�X=0.2mol���ʷ�Ӧ�ﵽƽ��ʱSO3��ת����Ϊ
��ã�X=0.2mol���ʷ�Ӧ�ﵽƽ��ʱSO3��ת����Ϊ ![]() =20%�������������ģ�˵����Ӧ�ӣ�1�����淽��ʼ�������ȣ����Ȼ�ѧ����ʽ2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1��֪��2SO3��g��2SO2��g��+O2��g����H=��196.6kJmol��1��1molSO3�ֽ�����98.3KJ����������0.2molSO3�ֽ����յ�����Q=98.3KJ��0.2=19.66KJ��
=20%�������������ģ�˵����Ӧ�ӣ�1�����淽��ʼ�������ȣ����Ȼ�ѧ����ʽ2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1��֪��2SO3��g��2SO2��g��+O2��g����H=��196.6kJmol��1��1molSO3�ֽ�����98.3KJ����������0.2molSO3�ֽ����յ�����Q=98.3KJ��0.2=19.66KJ��
���Դ��ǣ�20%�����գ�19.66����2������ͼ���֪��3min��09min�ڶ�����̼Ũ�ȼ�����0.25mol/L�����ʱ�����������Ũ�ȼ���3��0.25mol/L=0.75mol/L����v��H2��= ![]() =0.125mol/L��
=0.125mol/L��
���Դ��ǣ�0.125��
��A����Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1��1ʱ��û�дﵽƽ��״̬����A����
B��������������������䣬������������䣬�������Ƿ�ﵽƽ��״̬��������ܶȶ����䣬��B����
C����ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ������Ƿ�ﵽƽ��״̬�������ڵ�λʱ����ÿ����3molH2 �� ͬʱ����1molH2O����C����
D��CO2����������ڻ�������б��ֲ��䣬˵���ﵽƽ��״̬����D��ȷ��
���Դ��ǣ�D����3��A������ƽ�ⳣ�����¶ȱ仯��ƽ���ƶ�ԭ�������жϣ����¶�����ƽ�ⳣ����С������ӦΪ���ȷ�Ӧ����A��ȷ��
B����A������ӦΪ���ȷ�Ӧ����H��0�����ݡ�G=��H��T��S��0�Է�����G=��H��T��S��0���Է������ڵ����²����Է����У������¿��Է����У�˵���÷�Ӧ��S��0
�� ��B��ȷ��
C�����ƽ������ʽ��ʽ���㣬ƽ�ⳣ������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻���
CO��g��+ | 2H2��g�� | CH3OH��g�� | ||
��ʼ����mol/L�� | 0.1 | 0.2 | 0 | |
�仯����mol/L�� | 0.1��50% | 0.1 | 0.05 | |
ƽ������mol/L�� | 0.05 | 0.1 | 0.05 |
ƽ�ⳣ��K= ![]() =100����C��ȷ��
=100����C��ȷ��
D������ƽ��������У��������Ǵ������������ԭ������ת���ʸߣ���D����
��ѡABC��
�����㾫����ͨ��������û�ѧƽ��״̬���ʼ������ͻ�ѧƽ��״̬���жϣ����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȼ����Խ����⣮


 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¹ʻ�ҩƷ�Ĵ�����ȷ����(����)
A.����Ũ����մ��Ƥ���ϣ�����������������Һ��ϴ
B.������CO�ж�ʱ��Ӧ�������ж���̧������ͨ�紦
C.��ȡ���ռ�����������Ӧ����ֹͣ����
D.��������ķ�Һ����ˮ�ۣ���ˮ������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
��1�������£�ij���Na2CO3����Һ�е����̪����Һ�ʺ�ɫ�������Һ��_______�ԣ�ԭ����___________________________���������ӷ���ʽ��ʾ��
��2���ڳ����½�pH=2������10mL��ˮϡ�͵�1L����ϡ�ͺ����Һ��pHֵ����________��
��3����֪��H2S��Һ�д�������ƽ�⣺H2SHS��+H+����H2S��Һ�м���NaOH����ʱ�����������¶ȱ仯������ƽ����________�ƶ�����������������������c��H+��________��������������������С��������������
����H2S��Һ�м���NaHS����ʱ������ƽ����________�ƶ�����������������������c��S2����________��������������������С��������������
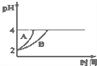
��4�������£�ȡpH=2������ʹ�����Һ��100mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ���________������A������B�������������м����Zn����Ϊm1 �� ������Һ�м����Zn����Ϊm2 �� ��m1________m2 �� ��ѡ������������=������������
��5�����ܵ������ˮ��Һ�д����ܽ�ƽ���� ijMgSO4��Һ��c��Mg2+��=0.002molL��1���������Mg��OH��2������Ӧ������ҺpH��ʹ֮����________�������¶���Mg��OH��2��Ksp=2��10��11��
��6�������£���NH4Cl��Һ������Ũ���ɴ�С��˳��Ϊ________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH4����ԭNOx�������������������Ⱦ����֪��
��CH4(g)��4NO2(g)===4NO(g)��CO2(g)��2H2O(g)��H����574 kJ��mol��1
��CH4(g)��4NO(g)===2N2(g)��CO2(g)��2H2O(g)��H����1 160 kJ��mol��1
����˵������ȷ����(����)
A. ��Ӧ�٢ھ�Ϊ���ȷ�Ӧ
B. �����ʵ����ļ���ֱ�����Ӧ�٢ڣ�ת�Ƶ�������ͬ
C. �ɷ�Ӧ�ٿ���֪��CH4(g)��4NO2(g)===4NO(g)��CO2(g)��2H2O(l)����H����a kJ��mol��1��a<574
D. ���ñ�״����4.48 L CH4��ԭNO2��N2���ų�������Ϊ173.4 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
2H2(g����O2(g��===2H2O(l�� ��H����571.6 kJ��mol��1
2CH3OH(l����3O2(g��===2CO2(g����4H2O(l����H����1452 kJ��mol��1
H��(aq����OH��(aq��===H2O(l�� ��H����57.3 kJ��mol��1
����˵����ȷ���� �� ��
A. H2(g����ȼ����Ϊ571.6 kJ��mol��1
B. ͬ������H2(g����CH3OH(l����ȫȼ�գ�H2(g���ų���������
C. ![]() H2SO4(aq����
H2SO4(aq����![]() Ba(OH��2(aq��===
Ba(OH��2(aq��===![]() BaSO4(s����H2O(l�� ��H����57.3 kJ��mol��1
BaSO4(s����H2O(l�� ��H����57.3 kJ��mol��1
D. 3H2(g����CO2(g��=CH3OH(l����H2O(l�� ��H����135.9 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ռ���Ʒ�к����������������õĿ��������ʣ�Ϊ�˲ⶨ�䴿�ȣ��������µζ������� A��ת�Ƶ�����ƿ���������Ƴ�250mL�ռ���Һ��
B������Һ�ܣ����ʽ�ζ��ܣ���ȡ25.00mL�ռ���Һ����ƿ�в��Ӽ��μ���ָʾ����
C������ƽ��ȷ��ȡ�ռ���ƷWg�����ձ��м�����ˮ�ܽ⣻
D�������ʵ���Ũ��ΪMmol/L�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶���ΪV1mL��
E������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2mL��
������������⣺
��1�������������ȷ˳���ǣ���д��ĸ����������
��2���ζ����յ�ʱ����ƿ����Һ��pHԼΪ �� �յ�ʱ��Һ��ɫ�仯��
��3������ʽ�ζ���û���ñ�H2SO4��Һ��ϴ����Բⶨ����к�Ӱ�����ƫ�ߡ�����ƫ�͡�����Ӱ�족��������������ȷ��
��4�����ռ���Ʒ�Ĵ��ȼ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ������������ֻ����Na����K����Ca2����Cl����NO3������֪����Na����K����Ca2����NO3����Ũ�Ⱦ�Ϊ0.1 mol��L��1����Cl�������ʵ���Ũ��Ϊ
A. 0.1 mol��L��1 B. 0.3 mol��L��1
C. 0.2 mol��L��1 D. 0.4 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֦������������о�����ṹ��ʽ��ͼ�����й��ڷ�֦���������ȷ���ǣ�������

A. �����Ҵ������ᷴӦ��Ҳ��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ
B. 1mol���л�����NaOH��Һ��Ӧ���������3mol NaOH
C. ��֦��ķ���ʽΪC10H8O6
D. ��֦������к���2�ֺ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
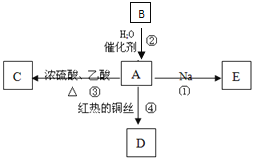
����Ŀ��A�dz������л����ʣ���������ˮ����������ζ��B�IJ����ɺ���һ������ʯ�ͻ�����չ��ˮƽ���й����ʵ�ת����ϵ��ͼ����ʾ����ش��������⣺
![]()
��1��B�ĽṹʽΪ____________��D���ʵ�������_________��
��2���ڢ����ܷ�Ӧ�У����ڼӳɷ�Ӧ����______________���Ӧ��ţ���
��3��д����Ӧ�ܵĻ�ѧ����ʽ��________________________��
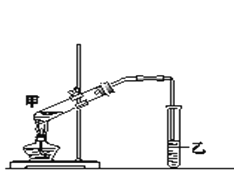
��4��ʵ������ͼ����ʾװ�ý��з�Ӧ��
a����Ӧ�۵Ļ�ѧ����ʽ��___________����Ӧ����Ϊ______��
b�����еĵ��ܲ������뵽Һ���µ�ԭ����__________________��
c��ʵ����ɺ��Թ����з�����л���C�ķ�����_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com