
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_______性,原因是___________________________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于________;
(3)已知在H2S溶液中存在下列平衡:H2SHS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向________移动,(填“左”或“右”)c(H+)________.(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向________移动,(填“左”或“右”)c(S2﹣)________.(填“增大”、“减小”或“不变”)
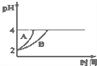
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 . 则m1________m2 . (选填“<”、“=”、“>”)
(5)难溶电解质在水溶液中存在溶解平衡, 某MgSO4溶液里c(Mg2+)=0.002molL﹣1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10﹣11)
(6)常温下,在NH4Cl溶液中离子浓度由大到小的顺序为________.
【答案】 碱性; CO32﹣+H2OHCO3﹣+OH﹣ 4 右 减小 左 增大 B < 10 c(Cl-)>c(NH4+)>c(H+)>c(OH-)
【解析】(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性,原因是 CO32﹣水解,CO32﹣+H2OHCO3﹣+OH﹣;(2)在常温下将pH=2的盐酸10mL加水稀释到1L,c(H+)=10-2mol·L-1×0.01L/1L=10-4mol·L-1,则稀释后的溶液的pH值等于-lg10-4=4;(3)①向H2S溶液中加入NaOH固体时,氢离子的浓度减小,电离平衡向右移动;②向H2S溶液中加入NaHS固体时,硫氢根离子浓度变大,H2S![]() HS-+H+电离平衡向左移动,硫氢根离子的电离,c(S2-)增大;(4)由于醋酸是弱电解质,与Zn反应时,末电离的醋酸不断电离出H+,pH变化较缓慢,B曲线是醋酸溶液的pH变化曲线。由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时,醋酸电离平衡正向移动,补充反应的氢离子,醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2。(5)0.002mol·L-1MgSO4溶液中c(Mg2+)=0.002mol·L-1,沉淀平衡时c(OH-)=
HS-+H+电离平衡向左移动,硫氢根离子的电离,c(S2-)增大;(4)由于醋酸是弱电解质,与Zn反应时,末电离的醋酸不断电离出H+,pH变化较缓慢,B曲线是醋酸溶液的pH变化曲线。由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时,醋酸电离平衡正向移动,补充反应的氢离子,醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2。(5)0.002mol·L-1MgSO4溶液中c(Mg2+)=0.002mol·L-1,沉淀平衡时c(OH-)=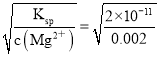 mol·L-1=10-4 mol·L-1,则c(H+)=10-10 mol·L-1,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10。(6)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(OH-)<c(H+),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+cH+)=c(Cl-)+c(OH-),所以得c(NH4+)<c(Cl-),铵根离子水解程度较小,所以常温下,在NH4Cl溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。
mol·L-1=10-4 mol·L-1,则c(H+)=10-10 mol·L-1,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10。(6)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(OH-)<c(H+),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+cH+)=c(Cl-)+c(OH-),所以得c(NH4+)<c(Cl-),铵根离子水解程度较小,所以常温下,在NH4Cl溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙醇和二氯甲烷都存在同分异构体
B.油脂在碱性条件下才能水解
C.制聚乙烯塑料的反应属于取代反应
D.高温消毒是利用蛋白质变性的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将0.6 mol A和0.5 mol B充入0.4 L密闭容器中发生2A(g)+B(g)![]() mD(g)+E(g),经过5 min后达到化学平衡,此时测得D为0.2 mol。又知5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5 min后达到化学平衡,此时测得D为0.2 mol。又知5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
A. A、B均转化了20% B. m值为2
C. 该温度下,反应的平衡常数K为1.33L·mol-1 D. 平衡时混合物总物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.能量之间可相互转化:电解食盐水制备氯气是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4 (aq),CuSO4 (aq);铜片,铁片,锌片和导线
(1)完成原电池甲的装置示意图,并作相应的标注。要求:在同一烧杯中,电极与溶液含相同的金属元素。_____________
(2)以铜片为电极之一,硫酸铜溶液为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极________________
(3)甲乙两种原电池中可更有效地将化学能转化为电能的是____________,其原因是_________________________
(4)根据牺牲阳极的阴极保护法原理,为了减缓电解质溶液中铁片的腐蚀,在上述的材料中应选__________作阳极。
Ⅱ. CO与H2反应还可制备C2H5OH,C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
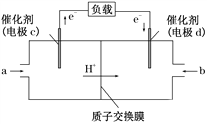
电池总反应为C2H5OH+3O2===2CO2+3H2O,则d电极是________(填“正极”或“负极”),c电极的反应方程式为_______________________________。若线路中转移2 mol电子,则上述燃料电池,消耗的O2在标况下的体积为______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”相关知识填空.
(1)147g H2SO4的物质的量是 , 其中含氢原子数为个.
(2)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为 , 含R的质量为1.6g的Na2R,其物质的量为 .
(3)在标准状况下,CO和CO2的混合气体共39.2L,质量为61g.则两种气体的物质的量之和mol.其中CO占总体积的%.
(4)448mL某气体在标准状况下的质量为1.28g,则该气体的相对分子质量为 .
(5)某混合物由NaCl、MgCl、AlCl3组成,已知Na、Mg、Al三元素的质量之比为23:16:9,则NaCl、MgCl2和AlCl3物质的量之比为 , 含1.00mol Cl﹣的该混合物的质量为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作错误的是
A.用药匙取用粉末状或小颗粒状固体B.用胶头滴管滴加少量液体
C.给盛有2/3体积液体的试管加热D.倾倒液体对试剂瓶标签面向手心
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在人们已能合成自然界并不存在的许多性能优良的有机高分子材料,如由氯乙烯合成聚氯乙烯,则适合于合成聚氯乙烯的原料是( )
A.CH4、Cl2
B.CH3CH3、HCl
C.CH≡CH、HCl
D.CH2=CH2、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1),请回答下列问题: 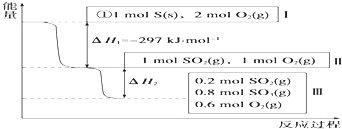
①写出能表示硫的燃烧热的热化学方程式: .
②在相同条件下,充入1mol SO3和0.5mol 的O2 , 则达到平衡时SO3的转化率为;此时该反应(填“放出”或“吸收”)KJ的能量.
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2 , 一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=molL﹣1min﹣1 . 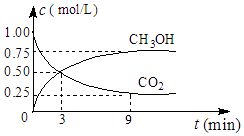
②能说明上述反应达到平衡状态的是(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2 , 同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数.下列说法正确的是
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2 , 达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2═2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( ) 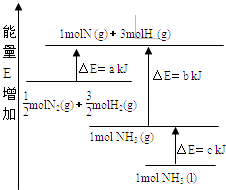
A.N2(g)+3H2(g)═2NH3(l);△H=2(a﹣b﹣c)kJmol﹣1
B.N2(g)+3H2(g)═2NH3(g);△H=2(b﹣a)kJmol﹣1
C.![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(l);△H=(b+c﹣a)kJmol﹣1
H2(g)═NH3(l);△H=(b+c﹣a)kJmol﹣1
D.![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g);△H=(a+b)kJmol﹣1
H2(g)═NH3(g);△H=(a+b)kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com