
【题目】一定温度下,将0.6 mol A和0.5 mol B充入0.4 L密闭容器中发生2A(g)+B(g)![]() mD(g)+E(g),经过5 min后达到化学平衡,此时测得D为0.2 mol。又知5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5 min后达到化学平衡,此时测得D为0.2 mol。又知5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
A. A、B均转化了20% B. m值为2
C. 该温度下,反应的平衡常数K为1.33L·mol-1 D. 平衡时混合物总物质的量为1 mol
【答案】C
【解析】5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,说明生成的E为0.5 mol·L-1,物质的量为0.5×0.4=0.2mol,则生成的D、E相等,所以m=1选项B错误。生成0.2molE,一定消耗了0.4molA和0.2molB,所以A的转化率为2/3,选项A错误。达平衡时c(A)=0.5mol/L,c(B)=3/4mol/L,c(D)=0.5mol/L,c(E)=0.5mol/L,所以K=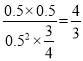 ,即1.33L·mol-1,选项C正确。平衡时A、B、D、E分别为0.2mol、0.3mol、0.2mol和0.2mol,总物质的量为0.9mol,选项D错误。
,即1.33L·mol-1,选项C正确。平衡时A、B、D、E分别为0.2mol、0.3mol、0.2mol和0.2mol,总物质的量为0.9mol,选项D错误。


科目:高中化学 来源: 题型:
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
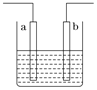
A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故或药品的处理正确的是( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.当出现CO中毒时,应立即将中毒者抬到室外通风处
C.制取并收集氧气结束后,应立即停止加热
D.将含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以苯为主要原料,采用以下路线合成利胆药——柳胺酚
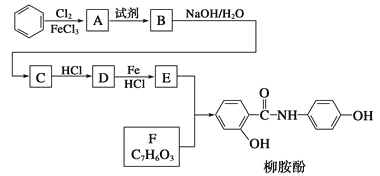
已知:![]()
回答下列问题:
(1)写出A→B反应所需的试剂______________,A→B反应类型为______________________。
(2)对于柳胺酚,下列说法正确的是___________。
A.1 mol柳胺酚最多可以和2 molNaOH反应 B. 可发生水解反应
C. 不能发生硝化反应 D.可与溴发生取代反应
(3)写出B→C的化学方程式__________________________________。
(4)写出化合物F的结构简式_____________________________。
(5)写出同时符合下列条件的F的同分异构体的结构简式________________________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子; ②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
![]() ____________________________________。
____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置示意图如下:

回答下列问题:
(1)检查装置气密性的方法是______________________,a的名称是_____________________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式___________________________________。
(3)C的作用是________________________,D的作用是________________,是否可以把C和D的位置对调并说明理由_________________________________。
(4)写出E中发生反应的化学方程式_____________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_______性,原因是___________________________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于________;
(3)已知在H2S溶液中存在下列平衡:H2SHS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向________移动,(填“左”或“右”)c(H+)________.(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向________移动,(填“左”或“右”)c(S2﹣)________.(填“增大”、“减小”或“不变”)
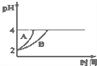
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 . 则m1________m2 . (选填“<”、“=”、“>”)
(5)难溶电解质在水溶液中存在溶解平衡, 某MgSO4溶液里c(Mg2+)=0.002molL﹣1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10﹣11)
(6)常温下,在NH4Cl溶液中离子浓度由大到小的顺序为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3-,已知其中Na+、K+、Ca2+、NO3-的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为
A. 0.1 mol·L-1 B. 0.3 mol·L-1
C. 0.2 mol·L-1 D. 0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com