
【题目】二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g)2ClNO(g) △H 1<0 其平衡常数为K1
ii.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=__________(用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO)=_________ ,平衡常数K2=___________;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:α1(NO2)______α2(NO2)(填“>”“<”或“=”)。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是______________。
a.c(Na+)=c(HSO3-)+2c(SO32-)
b.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
c.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
d.c(OH-) +c(SO32-)=c(H2SO3)+c(H+)
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
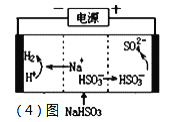
①工作一段时间后,阴极区溶液的pH______(填“增大”“减小”或“不变”);
②写出阳极的电极反应式_______________________。
【答案】K22/K1 2△H2-△H1 0.0025mol/(L·min) 10 < ac 增大 HSO3-—2e-+H2O=SO42-+3H+
【解析】
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),根据ii ×2- i 得到反应热△H 3,根据平衡常数计算公式结合反应ii、i求出此反应的平衡常数K3与K1、K2的关系式;
(2)①根据平衡时NO2的转化率可以求出其它物质的变化量,反应达到平衡后各物质的浓度,根据平衡常数的计算公式进行计算平衡常数;
②反应在恒容条件下进行,达到平衡时压强减少,若先在恒压条件下进行,可在平衡时增大压强,此时平衡向正反应方向进行,进而分析NO2转化率变化规律;
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,说明溶液的成份为Na2SO3和NaHSO3,根据电荷守恒和物料守恒进行分析;
(4)①阴极区溶液中的H+被还原成H2,氢离子浓度减小,氢氧根离子浓度增大,溶液的pH增大;
②阳极区HSO3-被氧化生成SO42-,据此写出电极反应方程式。
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),根据盖斯定律ii ×2- i 得到,反应热△H 3=2△H 2-△H1 ;K1= c2(ClNO)/c(Cl2)×c(NO),K2= c(ClNO)/c2(NO2),K3= c(Cl2)×c2(NO)/ c4(NO2),所以4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)反应的的平衡常数K3=(K2)2/K1;
故答案为:K22/K1;2△H2-△H1;
(2)①平衡时NO2的转化率为50%,NO2的变化量为0.1mol,ClNO的变化量为 0.05mol,V(ClNO)=[0.05/2]/10=0.0025mol/(L·min) ;结合NO2的变化量可知平衡时,c(NO2)=0.05mol/L,c(ClNO)=0.025 mol/L,故平衡常数K2=![]() =10;
=10;
故答案为:0.0025mol/(L·min);10;
②反应在恒容条件下进行,达到平衡时压强减少,若先在恒压条件下进行,可在平衡时增大压强,此时平衡向正反应方向进行,所以NO2转化率增大,即:α1(NO2)<α2(NO2);
故答案为:<;
(3)a.若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,说明溶液的成份为Na2SO3和NaHSO3,此时溶液中存在电荷守恒:c(H+)+ c(Na+)= c(HSO3-)+2 c(SO32-)+ c(OH-),溶液为中性,c(H+)= c(OH-),则a正确;
b.溶液中存在SO32-的水解与HSO3-的电离和水解,溶液中存在SO32-的水解与HSO3-的电离和水解,因此c(HSO3-) ≠c(SO32-),故b错误;
c.溶液中的水解和电离过程均相对较弱,所以溶液中的c(SO32-)> c(H2SO3),根据c(Na+)= c(HSO3-)+2 c(SO32-),所以c(Na+)> c(H2SO3)+ c(HSO3-)+ c(SO32-),故c正确;
d.由于反应后溶液呈中性,c(H+)= c(OH-);溶液中的水解和电离过程均相对较弱,所以溶液中的c(SO32-)> c(H2SO3),所以c(OH-) +c(SO32-)>c(H2SO3)+c(H+),故d错误;
故答案为:ac;
(4)①阴极区溶液中的H+被还原成H2,工作一段时间后,阴极区溶液的pH增大;
故答案为:增大;
②阳极区HSO3-被氧化生成SO42-,电极反应式HSO3-—2e-+H2O=SO42-+3H+;
故答案为:HSO3--2e-+H2O=SO42-+3H+。


科目:高中化学 来源: 题型:
【题目】某小组同学要配制100 mL 0.100molL﹣1Na2CO3溶液。下图是一些关键步骤和操作。
A. B.
B.![]() C.
C.
D.  E.
E.  F.
F. 
(1)配制过程的先后顺序为(用字母A~F填写)_______。
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、_______。
(3)用Na2CO310H2O来配制溶液,若晶体已经部分失去结晶水,则所配得溶液的浓度会___(填“偏高”、“偏低”、“不变”)。
(4)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将__(填“偏高”、“偏低”、“不变”);步骤F称为___,如果俯视刻度线,配得溶液的浓度将___(填“偏高”、“偏低”、“不变”)。
(5)在步骤B之后,需_____才进行下一步操作。(Na2CO310H2O溶于水放热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律 150 周年。下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素,W 原子最外层电子数是其内层电子数的 3 倍。下列说法正确的是( )
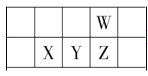
A.原子半径:W>X
B.最高价氧化物的水化物酸性:Y>Z
C.气态氢化物沸点:Z>W
D.气态氢化物热稳定性:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含镍酸性废水中用电解法可以实现铁上镀镍并得到氯化钠,其装置如图所示,下列叙述错误的是

A. 待镀铁棒为阴极
B. 选用镍棒替换碳棒,镀镍效果更好
C. 通电后中间隔室的NaCl溶液浓度增大
D. 阳极的电极反应式为4OH- — 4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 | ____________ | ____________ |
验证不稳定性 | ____________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡,某研究性学习小组在实验室用以下装置模拟四氯化锡的制备(夹持装置略)。

已知:①金属锡熔点为231℃,化学活泼性与铁相似。
②SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解生成SnO2·xH2O,在潮湿的空气中发烟。
③SnCl2中的Sn2+易被氧化为Sn4+。
请回答下列问题:
(1)仪器F的名称是_______________,装置B中的试剂是_____________(填名称)。
(2)实验前应先点燃_________(填“A”或“E”)处的酒精灯,待__________(填实验现象)后,再点燃另外一处的酒精灯。
(3)若没有装置C(其他均相同),则D中发生的主要副反应的化学方程式为__________。
(4)该实验装置存在设计缺陷,你的改进措施为______________________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取0.7500g锡粉溶于足量稀盐酸中,向生成的SnCl2溶液中加入过量的FeCl3溶液,用物质的量浓度为0.1000molL-1 K2Cr2O7标准溶液滴定生成的Fe2+(已知酸性环境下Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液的体积为20.00mL。
①锡粒中锡的质量分数_____。
②若溶解锡粉的过程生成的SnCl2溶液中含有Sn![]() ,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:
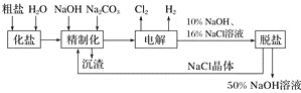
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com