
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热时都能产生红色沉淀 | |
| D. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 |
分析 A.依据二氧化硫、次氯酸漂白原理解答;
B.氯化铵受热分解生成氨气与氯化氢,碘受热升华;
C.福尔马林,葡萄糖都具有还原性,能够还原氢氧化铜生成红色氧化亚铜;
D.乙烯能被酸性高锰酸钾氧化,能与溴水加成.
解答 解:A.氯气的漂白作用是氯气和水反应生成的次氯酸的漂白作用,是次氯酸的强氧化性的体现;二氧化硫的漂白作用是二氧化硫与水生成的亚硫酸和有色物质结合为不稳定的无色物质,该过程为化合反应,二者原理不同,故A选;
B.氯化铵受热分解生成氨气与氯化氢属于化学变化,碘受热升华属于物理变化,二者原理不同,故B选;
C.福尔马林,葡萄糖都具有还原性,能够还原氢氧化铜生成红色氧化亚铜,二者原理相同,故C不选;
D.乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色,前者是发生氧化还原反应,后者发生加成反应,二者原理不同,故D选;
故选:ABD.
点评 本题考查了元素化合物知识,明确物质的性质是解题关键,注意次氯酸与二氧化硫漂白原理的不同,注意有机物结构特点,题目难度不大.


科目:高中化学 来源: 题型:解答题
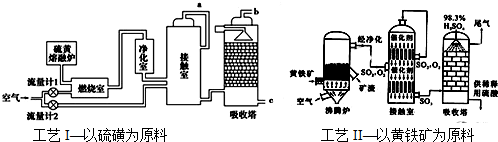
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
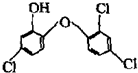 据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )
据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 哥罗芳存在同分异构体 | |
| C. | 1mol三氯生最多能与4molNaOH溶液反应 | |
| D. | 三氯生遇FeCl3溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素中X的气态氢化物最稳定 | |
| B. | X、Y、Z所形成的化合物只含有共价键 | |
| C. | Z的最高价氧化物对应的水化物化学式为H3ZO4 | |
| D. | X与Y可形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| B. | 化学反应必然伴随发生能量变化 | |
| C. | 利用生物质能就是间接利用太阳能 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)=0.25mol•L-1•min-1 | B. | v(H2)=0.5mol•L-1•min-1 | ||
| C. | v(NH3)=1mol•L-1•min-1 | D. | v(NH3)=0.25mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 →
→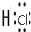 .
. 或
或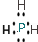 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com