
����Ŀ�����й������ʽṹ�������У�����������У� ��
��CH3COOH������̼ԭ�ӵ��ӻ�������sp2��sp3����
�ڷǼ��Է����������и߶ȶԳ��ԣ���BF3��NF3��H2O2��CO2�����ķ���
��Cu��OH��2��һ����ɫ��״�����������������ᡢҲ�����ڰ�ˮ����������������
�ܰ�ˮ�д�NH3��H2O���������������������ʾ����ϳ�NH3��H2O���ӣ����ݰ�ˮ�����ʿ�֪NH3��H2O�Ľṹʽ�ɼ�Ϊ��
A.0��B.1��C.2��D.3��
���𰸡�B
��������
�ټ��У�̼ԭ�Ӽ۲���ӶԸ���=��������+�µ��ӶԸ���=4+0=4������Ϊsp3�ӻ���-COOH�У�̼ԭ�Ӽ۲���ӶԸ���=3+0=3���γ�3���������¶Ե��ӣ��ӻ���ʽΪsp2�ӻ����ʢ���ȷ��
��NF3��H2O2�ṹ���Գƣ����ڼ��Է��ӣ��ʢڴ���
��Cu(OH)2�Ͱ�ˮ��Ӧ����������ӣ�����Cu(OH)2�����ڰ�ˮ�У�Cu(OH)2���ڼ����������ᣬNaHSO4��ˮ��Һ����ȫ����ΪNa+��H+��SO42-��H+����Cu(OH)2��Ӧ���ʢ���ȷ��
�����Ӧ�γ���X��H-Y��ʽ���У�X��Y������N��O��FԪ��֮һ������NH3��H2O�Ľṹʽ�����ֿ��ܣ�H3N��H-O-H��H2N-H��OH2������NH3��H2O�ɵ����NH4+��OH-�����Ե�1�ֽṹ�����ģ�����Ǻ���Ӧ�����NH2����H3O���ʢ���ȷ��
�ʴ����ֻ�Тڣ���1�֣�
��ѡB��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.ˮ�����ӻ�![]() ֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶�
ֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶�
B.![]() ���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й�
���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й�
C.�����£���![]() ��
��![]() ��Һ�м�������
��Һ�м�������![]() ���壬��ʹ��Һ��pH��С��
���壬��ʹ��Һ��pH��С�� �ı�ֵ����
�ı�ֵ����
D.�����£�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��Һ�е�c
��Һ�е�c![]() ��
��![]() �е�
�е�![]() ���
���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���Ӧ2NO2��g��N2O4��g����H<0,�ﵽƽ��ʱNO2������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��������
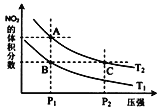
A.�¶ȣ�T1>T2
B.A��B�����Ӧ��ƽ�ⳣ����KA>KB
C.A�㣺2v��NO2���� �T v��N2O4����
D.B��C���������ƽ��Ħ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����淴Ӧ 2NO2��g��![]() 2NO��g����O2��g��������̶����ܱ������з�Ӧ�� �ﵽƽ��״̬�ı�־�ǣ� ��
2NO��g����O2��g��������̶����ܱ������з�Ӧ�� �ﵽƽ��״̬�ı�־�ǣ� ��
�ٵ�λʱ�������� n mol O2��ͬʱ���� 2n mol NO2
��v ����NO��=v ����NO2��
��ÿ���� 32g ������ͬʱ���� 60g NO
�ܻ�������ѹǿ���ٸı�
�ݻ���������ɫ���ٸı�
��������ƽ����Է����������ٸı�
���������ܶȲ��ٸı�
A.�٢ܢݢ�B.�٢ڢۢ�C.�٢ڢۢܢ�D.�٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Լӵ�ʳ���е���ؽ����о����������ϵ�֪���������һ�ְ�ɫ��ĩ�������º��ȶ���������560�濪ʼ�ֽ⡣�����������µ������һ�ֽ�ǿ����������HI��H2O2���������ã�����ԭΪ���ʵ⡣
��1��ѧ�������ʵ�����ӵ�ʳ���е�Ԫ�صĺ������������£�
�ٳ�ȡwg�ӵ��Σ�����������ˮ�ܽ⡣
����ϡ�����ữ���õ���Һ���ټ������KI��Һ��д���ò���Ӧ�����ӷ���ʽ��_______��
���Ե���Ϊָʾ���������ʵ���Ũ��Ϊ1.00��10-3molL-1��Na2S2O3��Һ�ζ�![]() �ζ�ʱ�ķ�Ӧ����ʽΪ
�ζ�ʱ�ķ�Ӧ����ʽΪ![]() ���ζ�ʱNa2S2O3��ҺӦ���� ______
���ζ�ʱNa2S2O3��ҺӦ���� ______ ![]() ������ʽ�ζ�����������ʽ�ζ�����
������ʽ�ζ�����������ʽ�ζ�����![]() ���ζ����յ������Ϊ_______________��
���ζ����յ������Ϊ_______________��
��2��ѧ���ҶԴ�����NaCl(����KIO3)����������ʵ�飺
˳�� | ���� | ʵ������ |
�� | ȡ����������NaCl������������ˮ�ܽ� | ��Һ�ޱ仯 |
�� | ������������-KI��Һ���� | ��Һ�ޱ仯 |
�� | Ȼ���ٵμ�ϡ���ᣬ�� | ��Һ����ɫ |
���Ʋ�ʵ����в�����ɫ����Ŀ���ԭ�� __________________ ������ѧ���ҵ�ʵ�������Ʋ�ѧ����ʵ�������� ______ (����ƫ��������ƫС��������Ӱ����)��
��3��ѧ�������ʵ��֤���ӵ�ʳ����Ʒ�е�Ԫ�صĴ�����ʽ��IO3-������I-����������ʵ�顣д��ʵ�鲽�衢Ԥ������ͽ��ۡ���ѡ�Լ���ϡ���ᡢϡ���ᡢ3% H2O2��Һ��������ˮ��1%������Һ������ˮ��
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ����ʳ����Ʒ���Թ��У�����������ˮʹ����ȫ�ܽ⣬ _____________________ | ______ |
����2����ȡ����ʳ����Ʒ���Թ��У�����������ˮʹ����ȫ�ܽ⣬����������ϡ�����ữ�� _____________________ | ______ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ɵĻ�����Һ�������һ���Ļ������ã�������������ֵ�Ũ���йء�����ʱ����ָ����Һ�������ʵ���Ũ�ȹ�ϵ��ȷ����
A.0.1 mol��L1 CH3COOH��Һ��c(CH3COOH)> c(CH3COO��) > c(H+)>c(OH��)
B.pH=8��CH3COOH��CH3COONa�����Һ��c(Na��)��c(CH3COO��) =9.9��10-7 mol��L-1
C.0.1 mol��L1CH3COOH��Һ��0.2 mol��L-1CH3COONa��Һ�������ϣ�2c(Na+)= 3c(CH3COO��)+3c(CH3COOH)
D.0.2 mol��L-1CH3COOH��Һ��0.1 mol��L-1NaOH��Һ�������ϣ�c(CH3COOH)+ 2c(H+)=c(CH3COO��)+2c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���뻯ѧƽ�����ƣ�����ƽ���ƽ�ⳣ�����������볣������K��ʾ�����±���ij�¶��¼��ֳ�������ĵ���ƽ�ⳣ����
�� | ���뷽��ʽ | ����ƽ�ⳣ��K |
CH3COOH | CH3COOH | 2��10-5 |
HClO | HClO | 3.0��10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4��10-7 K2=5.6��10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1��10-3 K2=6.3��10-8 K3=4.2��10-13 |
�ش��������⣺
��1������CH3COOH��HClO��H2CO3��HCO3-��H3PO4��H2PO4-��HPO42-���������ᣬ������������ǿ����___________���ѧʽ����
��2����NaClO��Һ��ͨ�������Ķ�����̼�����������ӷ���ʽΪ________��
��3�����¶���0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ���������__��
A c��H+�� B c��H+��c��CH3COO![]()
��4��ȡ�������pH��Ϊa�Ĵ���ʹ���������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һǡ���кͣ����ĵ�NaOH��Һ������ֱ�ΪV1��V2�����С��ϵΪ��V1_________V2����������������������=������
��5�������������ӽ��H+������ǿ����________��
A HCO3- B CO32- C ClO- D CH3COO-
��6�������ʵ����Ŀ����Ʒֱ���pHΪ2��3�Ĵ�����Һ�кͣ������Ĵ�����Һ���������ΪVa��Vb�������ߵĹ�ϵ��ȷ����_________��
A Va��10Vb B Va��10Vb C Vb��10Va D Vb��10Va
��7����֪100��ʱ��ˮ�����ӻ�����Kw=1.0��10-12��pH=3��CH3COOH��pH=9��NaOH��Һ�������ϣ������Һ��_____________�ԣ�
��8����Ũ�ȵĢ٣�NH4��2SO4����NH4HSO4����NH4HCO3����NH4Cl����NH3H2O��Һ�У�NH4+Ũ���ɴ�С��˳���ǣ�_________��
��9��������¶���CH3COONa��ˮ��ƽ�ⳣ��Kh_________��
��10�����ʵ���Ũ����ͬ��������Һ��a CH3COONa��b NaHCO3��c NaClO��d Na2CO3
������Һ��pH��С�������е�˳����____________���ñ����д����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2(g)��3H2(g) ![]() 2NH3(g)����H<0�����и����ʾ��ͼ�Ľ�����ͼ���������
2NH3(g)����H<0�����и����ʾ��ͼ�Ľ�����ͼ���������

A. ��ѹǿ�Է�Ӧ��Ӱ��(p2>p1) B. ���¶ȶԷ�Ӧ��Ӱ��
C. ��ƽ����ϵ����N2�Է�Ӧ��Ӱ�� D. �ܴ����Է�Ӧ��Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.05molSO2(g)��0.03molO2(g)�����ݻ�Ϊ1L���ܱ������У���Ӧ2SO2(g)+O2(g)![]() 2SO3(g)����һ�������´ﵽƽ�⣬���c(SO3)=0.04mol��L-1�����±�����ȷ����
2SO3(g)����һ�������´ﵽƽ�⣬���c(SO3)=0.04mol��L-1�����±�����ȷ����
A.�������·�Ӧ��ƽ�ⳣ��Ϊ1.6��103
B.ͨ������£��÷�Ӧһ�����Է�����
C.��������£�O2��ת������20%
D.����ϵ��SO2��SO3������֮����1:1ʱ����÷�Ӧ�ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com