
【题目】下列说法正确的是
A.水的离子积![]() 只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.![]() 不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在![]() 的
的![]() 溶液中加入少量
溶液中加入少量![]() 晶体,能使溶液的pH减小,
晶体,能使溶液的pH减小, 的比值增大
的比值增大
D.室温下,![]() 的
的![]() ,
,![]() 的
的![]() ,
,![]() 溶液中的c
溶液中的c![]() 与
与![]() 中的
中的![]() 相等
相等
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】用实验确定某酸HA是弱电解质。甲、乙两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol/L的HA溶液100 mL;②用pH试纸测出该溶液的pH,即能证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释至100 ml;③各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________1(填“>”“<”或“=”),乙方案中,说明HA是弱电解质的现象是________(填序号)。
a.装盐酸的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两个试管中产生气体的速率一样快
(2)请你评价乙方案中难以实现之处和不妥之处________。
(3)请你再提出一个合理而比较容易进行的方案(药品可任用),请表述实验方案:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水;已知:
N2H4 (g)+O2 (g)=N2(g)+2H2O (g) △H=-543kJ/mol
N2 (g)+2O2 (g)=2NO2 (g) △H=+67.7kJ/mol
H2 (g)+![]() O2 (g)=H2O (g) △H=-242kJ/mol
O2 (g)=H2O (g) △H=-242kJ/mol
![]() H2 (g)+
H2 (g)+![]() F2 (g)=HF (g) △H=-269kJ/mol
F2 (g)=HF (g) △H=-269kJ/mol
①肼和二氧化氮反应的热化学方程式为_______________________;
②有人认为若用氟气代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟气反应的热化学方程式:_______________________
(2)某同学做浓度对化学反应速率的影响的实验时,将3支试管编号为①②③,并按下表中物质的量进行实验,记录下的时间数据是:16 s、28 s、33 s。请将3个数据填入下表的适当位置,并写出实验结论。
①将对应①、②、③的时间分别写出:(a)________,(b)______,(c)________。
②实验结论:___________。
③写出反应的化学方程式___________。
试管编号 | 加3%Na2S2O3 | 加H2O | 加H2SO4(1∶5) | 出现浑浊时间 |
① | 3 mL | 3 mL | 5滴 | (a) s |
② | 4 mL | 2 mL | 5滴 | (b) s |
③ | 5 mL | 1 mL | 5滴 | (c) s |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中发生反应:2X(g)+Y(g) ![]() 2Z(g), 平衡后的某一时刻(t1)改变了外界条件,其反应速率随时间的变化图像如图所示,则下列说法符合该图像的是( )
2Z(g), 平衡后的某一时刻(t1)改变了外界条件,其反应速率随时间的变化图像如图所示,则下列说法符合该图像的是( )
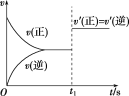
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() 的
的![]() 溶液体系中,含A粒子的分布系数
溶液体系中,含A粒子的分布系数![]() 平衡时某粒子的浓度占各粒子浓度之和的分数
平衡时某粒子的浓度占各粒子浓度之和的分数![]() 与溶液pH的关系如图所示.下列说法不正确的是
与溶液pH的关系如图所示.下列说法不正确的是
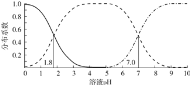
A.室温下,![]() 的电离常数
的电离常数![]()
B.室温下,![]() 的NaHA溶液显酸性
的NaHA溶液显酸性
C.室温下,![]() 的
的![]() 与
与![]() 的NaOH溶液等体积混合,溶液
的NaOH溶液等体积混合,溶液![]()
D.![]() 的
的![]() 溶液中
溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )
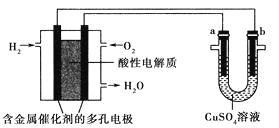
A. 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B. 电解精炼铜时,若转移1mol电子,a极质量减少32g
C. 铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
D. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的O2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种重要的化工原料。用废加氢催化剂(含有MoS2和Al2O3、Fe2O3、SiO2等)为原料制取钼酸钠,工艺流程如图所示:

已知:MoO3、A12O3在高温下能跟Na2CO3发生反应。
回答下列问题:
(1)Na2MoO4中Mo元素的化合价______。
(2)废加氢催化剂焙烧目的是脱除表面油脂、硫等。请根据表中实验数据分析,废加氢催化剂预处理温度应选择______℃。
废催化剂在不同温度下的烧残(时间:2h)
温度 /℃ | 300 | 350 | 400 | 500 | 600 |
烧前 /g | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
烧后 /g | 48.09 | 47.48 | 47.19 | 46.55 | 46.52 |
烧残, % | 96.2 | 95.0 | 94.4 | 93.1 | 93.0 |
(3)焙烧时生成MoO3的化学方程式为______,当生成1mol MoO3转移电子数为______NA。
(4)加碳酸钠碱性焙烧时主要反应的化学方程式为______。
(5)用50t含MoS2为80%的废加氢催化剂,经过制取、分离、提纯,得到30.9t Na2MoO4,则Na2MoO4的产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
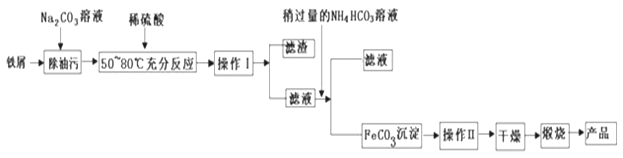
回答下列问题:
(1)操作Ⅰ、II的名称分别是______、_______.写出在空气中煅烧FeCO3生成Fe2O3的化学方程式__________________________。
(2)某同学在实验室中用KMnO4溶液滴定的方法来测定绿矾(FeSO47H2O)样品的纯度,操作过程如下:
a.称取3.00g绿矾(FeSO47H2O)样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定达到终点时锥形瓶中溶液颜色变化为:__________________且半分钟内不恢复原色
②计算上述样品中FeSO47H2O的质量分数为_______ 已知(M(FeSO47H2O)=278g/mol)
③写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式_________________________
④下列操作会导致样品中FeSO47H2O的质量分数的测定结果偏高的有_________.
a.盛装标准液的滴定管没有用标准液润洗
b.未干燥锥形瓶
c.滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质结构的命题中,错误的项数有( )
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②非极性分子往往具有高度对称性,如BF3、NF3、H2O2、CO2这样的分子
③Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
④氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为:
A.0个B.1个C.2个D.3个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com