
【题目】室温下,![]() 的
的![]() 溶液体系中,含A粒子的分布系数
溶液体系中,含A粒子的分布系数![]() 平衡时某粒子的浓度占各粒子浓度之和的分数
平衡时某粒子的浓度占各粒子浓度之和的分数![]() 与溶液pH的关系如图所示.下列说法不正确的是
与溶液pH的关系如图所示.下列说法不正确的是
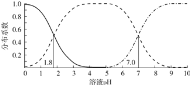
A.室温下,![]() 的电离常数
的电离常数![]()
B.室温下,![]() 的NaHA溶液显酸性
的NaHA溶液显酸性
C.室温下,![]() 的
的![]() 与
与![]() 的NaOH溶液等体积混合,溶液
的NaOH溶液等体积混合,溶液![]()
D.![]() 的
的![]() 溶液中
溶液中![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
B. 1mol该有机物与NaOH溶液反应,最多消耗3mol NaOH
C. 分枝酸的分子式为C10H8O6
D. 分枝酸分子中含有2种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向纯水中加入少量的硫酸氢钠固体(温度不变),则溶液的 ( )
A.pH升高B.酸性增强C.c(OH一)增大D.水中c(H+)与c(OH-)的乘积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是

A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中![]() 减小
减小
C.b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-)
D.c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程中的能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
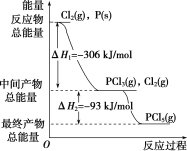
根据如图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式是________________________________________________________。
(2)PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式是_____________________。
(3)P(s)和Cl2(g)分两步反应生成1 mol PCl5(g)的ΔH3=____,P(s)和Cl2(g)一步反应生成1 mol PCl5(g)的ΔH4____(填“大于”“小于”或“等于”)ΔH3。
(4)已知1mol白磷变成1mol红磷放出18.39KJ的热量和下列两个热化学方程式:
4P(白磷,s)+5O2(g)=2P2O5(s) ΔH1,
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2。
则ΔH1和ΔH2的关系正确的是(______)
A.ΔH1=ΔH2 B.ΔH1>ΔH2 C.ΔH1<ΔH2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.水的离子积![]() 只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.![]() 不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在![]() 的
的![]() 溶液中加入少量
溶液中加入少量![]() 晶体,能使溶液的pH减小,
晶体,能使溶液的pH减小, 的比值增大
的比值增大
D.室温下,![]() 的
的![]() ,
,![]() 的
的![]() ,
,![]() 溶液中的c
溶液中的c![]() 与
与![]() 中的
中的![]() 相等
相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中用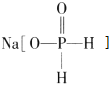 (次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是( )
(次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是( )
A.化学反应中,还原产物为Cu和H2
B.CuSO4溶液中离子浓度的大小顺序为c(SO42-)>c(Cu2+)>c(OH-)>c(H+)
C.溶液中H2PO2-的电离方程式为H2PO2-H++HPO22-
D.NaH2PO3与过量NaOH反应生成Na2HPO3,判断H3PO3为二元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂与HI、H2O2等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
①称取wg加碘盐,加适量蒸馏水溶解。
②用稀硫酸酸化所得的溶液,再加入过量KI溶液,写出该步反应的离子方程式:_______。
③以淀粉为指示剂,用物质的量浓度为1.00×10-3molL-1的Na2S2O3溶液滴定![]() 滴定时的反应方程式为
滴定时的反应方程式为![]() ,滴定时Na2S2O3溶液应放在 ______
,滴定时Na2S2O3溶液应放在 ______ ![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() ,滴定至终点的现象为_______________。
,滴定至终点的现象为_______________。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因: __________________ ;根据学生乙的实验结果可推测学生甲的实验结果可能 ______ (填“偏大”、“偏小”或“无影响”)。
(3)学生丙设计实验证明加碘食盐样品中碘元素的存在形式是IO3-而不是I-,进行如下实验。写出实验步骤、预期现象和结论。限选试剂:稀硫酸、稀硝酸、3% H2O2溶液、新制氯水、1%淀粉溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, _____________________ | ______ |
步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, _____________________ | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com