
【题目】化工生产中用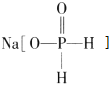 (次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是( )
(次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是( )
A.化学反应中,还原产物为Cu和H2
B.CuSO4溶液中离子浓度的大小顺序为c(SO42-)>c(Cu2+)>c(OH-)>c(H+)
C.溶液中H2PO2-的电离方程式为H2PO2-H++HPO22-
D.NaH2PO3与过量NaOH反应生成Na2HPO3,判断H3PO3为二元酸
【答案】AD
【解析】
A、反应中,Cu、H元素化合价降低、发生还原反应,P元素化合价升高、发生氧化反应;
B、CuSO4是强酸弱碱盐,水解显酸性,结合电荷关系判断;
C、根据次磷酸钠的物质结构可知,H3PO2是一元酸,H2PO2-不能电离;
D、NaH2PO3与过量NaOH反应生成Na2HPO3,则NaH2PO3为酸式盐、Na2HPO3是正盐。
A、反应CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑中,Cu、H元素化合价降低、发生还原反应,所以Cu和H2为还原产物,故A正确;
B、CuSO4是强酸弱碱盐,水解显酸性,即c(H+)>c(OH-),电荷关系为2c(SO42-)+c(OH-)=2c(Cu2+)+c(H+),即c(SO42-)>c(Cu2+),所以CuSO4溶液中离子浓度的大小顺序为c(SO42-)>c(Cu2+)>c(H+)>c(OH-),故B错误;
C、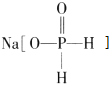 中H2PO2-没有羟基,所以次磷酸钠为正盐,H2PO2-不能电离出H+,但能水解,故C错误;
中H2PO2-没有羟基,所以次磷酸钠为正盐,H2PO2-不能电离出H+,但能水解,故C错误;
D、NaH2PO3与过量NaOH反应生成Na2HPO3,则NaH2PO3为酸式盐、Na2HPO3是正盐,说明H3PO3分子中只有两个羟基,所以H3PO3为二元酸,故D正确;
故选:AD。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 能发生反应
能发生反应![]() 未配平
未配平![]() :
:![]() 。该反应的速率v随
。该反应的速率v随![]() 的增大而增大,如图是v
的增大而增大,如图是v ![]() 图。下列说法中不正确的是
图。下列说法中不正确的是
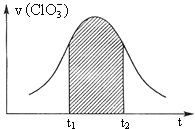
A.开始时反应速率增大可能是由![]() 增大所致
增大所致
B.纵坐标为![]() 的
的![]() 曲线与图曲线完全重合
曲线与图曲线完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.阴影部分面积可以表示![]() 时间内
时间内![]() 增加
增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() 的
的![]() 溶液体系中,含A粒子的分布系数
溶液体系中,含A粒子的分布系数![]() 平衡时某粒子的浓度占各粒子浓度之和的分数
平衡时某粒子的浓度占各粒子浓度之和的分数![]() 与溶液pH的关系如图所示.下列说法不正确的是
与溶液pH的关系如图所示.下列说法不正确的是
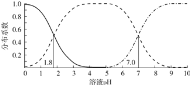
A.室温下,![]() 的电离常数
的电离常数![]()
B.室温下,![]() 的NaHA溶液显酸性
的NaHA溶液显酸性
C.室温下,![]() 的
的![]() 与
与![]() 的NaOH溶液等体积混合,溶液
的NaOH溶液等体积混合,溶液![]()
D.![]() 的
的![]() 溶液中
溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种重要的化工原料。用废加氢催化剂(含有MoS2和Al2O3、Fe2O3、SiO2等)为原料制取钼酸钠,工艺流程如图所示:

已知:MoO3、A12O3在高温下能跟Na2CO3发生反应。
回答下列问题:
(1)Na2MoO4中Mo元素的化合价______。
(2)废加氢催化剂焙烧目的是脱除表面油脂、硫等。请根据表中实验数据分析,废加氢催化剂预处理温度应选择______℃。
废催化剂在不同温度下的烧残(时间:2h)
温度 /℃ | 300 | 350 | 400 | 500 | 600 |
烧前 /g | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
烧后 /g | 48.09 | 47.48 | 47.19 | 46.55 | 46.52 |
烧残, % | 96.2 | 95.0 | 94.4 | 93.1 | 93.0 |
(3)焙烧时生成MoO3的化学方程式为______,当生成1mol MoO3转移电子数为______NA。
(4)加碳酸钠碱性焙烧时主要反应的化学方程式为______。
(5)用50t含MoS2为80%的废加氢催化剂,经过制取、分离、提纯,得到30.9t Na2MoO4,则Na2MoO4的产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)是一种常用的储氢材料。某化学兴趣小组制取氢化钙的实验装置如图:资料:氢化钙要密封保存,在空气中容易变质。下列说法不正确的是( )
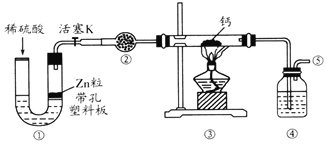
A.②和④中分别盛装碱石灰和浓硫酸
B.反应结束后,应先停止加热,通气一段时间再关闭活塞K
C.点燃酒精灯前,先用试管在⑤处收集气体并点燃,通过声音判断气体纯度
D.装置①也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
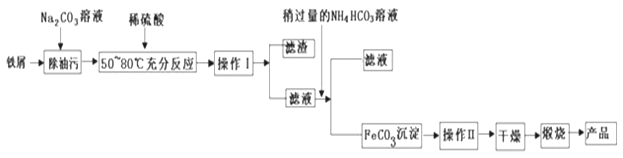
回答下列问题:
(1)操作Ⅰ、II的名称分别是______、_______.写出在空气中煅烧FeCO3生成Fe2O3的化学方程式__________________________。
(2)某同学在实验室中用KMnO4溶液滴定的方法来测定绿矾(FeSO47H2O)样品的纯度,操作过程如下:
a.称取3.00g绿矾(FeSO47H2O)样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定达到终点时锥形瓶中溶液颜色变化为:__________________且半分钟内不恢复原色
②计算上述样品中FeSO47H2O的质量分数为_______ 已知(M(FeSO47H2O)=278g/mol)
③写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式_________________________
④下列操作会导致样品中FeSO47H2O的质量分数的测定结果偏高的有_________.
a.盛装标准液的滴定管没有用标准液润洗
b.未干燥锥形瓶
c.滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组探究FeCl3溶液与Na2S溶液的反应产物,利用图装置进行如下实验:
Ⅰ.向盛有0.1 molL-1FeCl3溶液的三颈瓶中,滴加一定量0.1 molL-1Na2S溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有0.1 molL-1 Na2S溶液的三颈瓶中,滴加少量0.1molL-1 FeCl3溶液,搅拌,产生沉淀B。
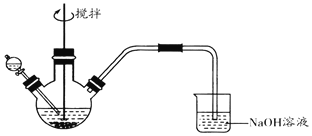
已知:①FeS2为黑色固体,且不溶于水和盐酸。②Ksp(Fe2S3)=1×10-88,Ksp(FeS2)=6.3×10-31,Ksp[Fe(OH)3]=1×10-38,Ksp(FeS)=4×10-19
回答下列问题:
(1)NaOH溶液的作用是______。
小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:
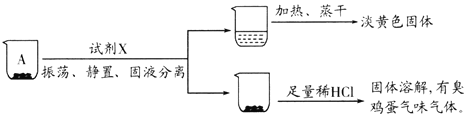
(2)试剂X是______。由此推断A的成分是______(填化学式)。
实验二、探究B的成分
取沉淀B于小烧杯中,进行如下实验:

(3)向试管a中加入试剂Y,观察到明显现象,证明溶液中存在Fe2+.试剂Y是______,明显现象是______。由此推断B的成分是______(填化学式)。
(4)请分析Ⅱ中实验未得到Fe(OH)3的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
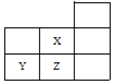
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数值,下列说法正确的是( )
为阿伏加德罗常数值,下列说法正确的是( )
A.![]()
![]() 含有6mol共价键
含有6mol共价键
B.![]() 溶液加热后,溶液的pH减小
溶液加热后,溶液的pH减小
C.常温常压下,![]()
![]() 中含有的分子数为
中含有的分子数为![]() 个
个
D.稀释![]() 溶液,
溶液,![]() 电离程度增大,溶液的导电能力增强
电离程度增大,溶液的导电能力增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com