
【题目】铁及其化合物在生产和生活中有着广泛的应用.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
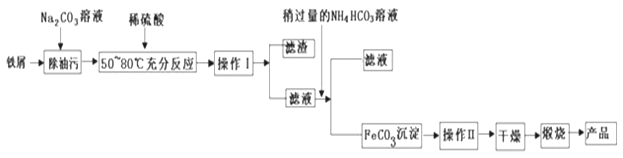
回答下列问题:
(1)操作Ⅰ、II的名称分别是______、_______.写出在空气中煅烧FeCO3生成Fe2O3的化学方程式__________________________。
(2)某同学在实验室中用KMnO4溶液滴定的方法来测定绿矾(FeSO47H2O)样品的纯度,操作过程如下:
a.称取3.00g绿矾(FeSO47H2O)样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定达到终点时锥形瓶中溶液颜色变化为:__________________且半分钟内不恢复原色
②计算上述样品中FeSO47H2O的质量分数为_______ 已知(M(FeSO47H2O)=278g/mol)
③写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式_________________________
④下列操作会导致样品中FeSO47H2O的质量分数的测定结果偏高的有_________.
a.盛装标准液的滴定管没有用标准液润洗
b.未干燥锥形瓶
c.滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
【答案】过滤 洗涤 4FeCO3+O2![]() 2Fe2O3+4CO2 溶液由浅绿色变成紫红色 0.9266 5Fe2++MnO4+8H+=Fe3++2Mn2++4H2O a d
2Fe2O3+4CO2 溶液由浅绿色变成紫红色 0.9266 5Fe2++MnO4+8H+=Fe3++2Mn2++4H2O a d
【解析】
(1)分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤;
(2)①.亚铁离子被氧化为三价铁离子,高锰酸钾溶液做指示剂,滴定终点时溶液由浅绿色变为紫红色,且半分钟内不立即褪去;
②.根据5Fe2+---MnO4-关系,计算出n(![]() ),从而配制的250mL溶液中含亚铁离子物质的量,根据n(Fe2+)=n(FeSO47H2O)关系计算出绿矾的质量,计算出质量分数;
),从而配制的250mL溶液中含亚铁离子物质的量,根据n(Fe2+)=n(FeSO47H2O)关系计算出绿矾的质量,计算出质量分数;
③高锰酸钾具有氧化性,能够把亚铁离子氧化为铁离子,据此写出离子方程式;
④依据滴定过程中c(待测)=c(标准)V(标准)/ V(待测),操作中引起的误差需要分析标准液的体积变化。
(1)分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤,故答案为:过滤;洗涤;在空气中煅烧![]() ,
,![]() 与氧气反应生成三氧化二铁和二氧化碳,故答案为:
与氧气反应生成三氧化二铁和二氧化碳,故答案为:![]() ;
;
(2)①滴定实验是利用高锰酸钾溶液的颜色变化指示反应终点,所以反应完全后,溶液呈紫红色,故答案为:溶液由浅绿色变为紫红色,且半分钟内不立即褪去;
②.依据步骤分析,25mL溶液被高锰酸钾溶液滴定反应,终点时消耗亚铁离子物质的量为:
![]()
1 5
1mol 5mol
故n(![]() )=0.001mol,配制的250mL溶液中含亚铁离子物质的量n=0.01mol;样品中绿矾的质量分数=
)=0.001mol,配制的250mL溶液中含亚铁离子物质的量n=0.01mol;样品中绿矾的质量分数=![]() ×100%=97.5%,故答案为:97.5%;
×100%=97.5%,故答案为:97.5%;
③高锰酸钾具有氧化性,能够把亚铁离子氧化为铁离子,本身被还原为锰离子,离子方程式为:![]() ;
;
④.依据滴定过程中c(待测)=c(标准)V(标准)/ V(待测),操作中引起的误差需要分析标准液的体积变化,a.盛装标准液的滴定管没有用标准液润洗,则导致标准液稀释浓度实际减小V(标准)增大,故结果偏高;b.未干燥锥形瓶,不影响待测液的物质的量的变化,故结果没变化;c.滴定终点时滴定管尖嘴中产生气泡,则V(标准)偏小故结果偏低;d.量取待测液,视线注视刻度时开始平视、结束俯视,俯视滴定管读数偏小,则V(待测)偏小,故测定结果偏高;故选a d;


科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2![]() 2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.水的离子积![]() 只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.![]() 不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在![]() 的
的![]() 溶液中加入少量
溶液中加入少量![]() 晶体,能使溶液的pH减小,
晶体,能使溶液的pH减小, 的比值增大
的比值增大
D.室温下,![]() 的
的![]() ,
,![]() 的
的![]() ,
,![]() 溶液中的c
溶液中的c![]() 与
与![]() 中的
中的![]() 相等
相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )
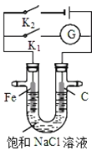
A.K1闭合,石墨棒周围溶液pH逐渐降低
B.K1闭合,铁棒上发生的反应为2H+ + 2e= H2↑
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极保护法
D.K2闭合,电路中通过0.2NA个电子时,两极共产生标况下4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中用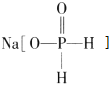 (次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是( )
(次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是( )
A.化学反应中,还原产物为Cu和H2
B.CuSO4溶液中离子浓度的大小顺序为c(SO42-)>c(Cu2+)>c(OH-)>c(H+)
C.溶液中H2PO2-的电离方程式为H2PO2-H++HPO22-
D.NaH2PO3与过量NaOH反应生成Na2HPO3,判断H3PO3为二元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应2NO2(g)N2O4(g)△H<0,达到平衡时NO2的体积分数与温度、压强的关系如图所示.下列说法正确的是 ( )
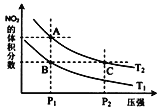
A.温度:T1>T2
B.A、B两点对应的平衡常数:KA>KB
C.A点:2v(NO2)正 ═ v(N2O4)逆
D.B、C两点气体的平均摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应 2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应, 达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中反应, 达到平衡状态的标志是( )
①单位时间内生成 n mol O2,同时生成 2n mol NO2
②v 正(NO)=v 逆(NO2)
③每消耗 32g 氧气,同时生成 60g NO
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
⑦混合气体的密度不再改变
A.①④⑤⑥B.①②③⑤C.①②③④⑤D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com