
����Ŀ�������ƣ�Na2MoO4����һ����Ҫ�Ļ���ԭ�ϡ��÷ϼ������������MoS2��Al2O3��Fe2O3��SiO2�ȣ�Ϊԭ����ȡ�����ƣ�����������ͼ��ʾ��

��֪��MoO3��A12O3�ڸ������ܸ�Na2CO3������Ӧ��
�ش��������⣺
(1)Na2MoO4��MoԪ�صĻ��ϼ�______��
(2)�ϼ����������Ŀ�����ѳ�������֬����ȡ�����ݱ���ʵ�����ݷ������ϼ������Ԥ�����¶�Ӧѡ��______����
�ϴ����ڲ�ͬ�¶��µ��ղУ�ʱ�䣺2h��
�¶� /�� | 300 | 350 | 400 | 500 | 600 |
��ǰ /g | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
�պ� /g | 48.09 | 47.48 | 47.19 | 46.55 | 46.52 |
�ղУ� % | 96.2 | 95.0 | 94.4 | 93.1 | 93.0 |
(3)����ʱ����MoO3�Ļ�ѧ����ʽΪ______��������1mol MoO3ת�Ƶ�����Ϊ______NA��
(4)��̼���Ƽ��Ա���ʱ��Ҫ��Ӧ�Ļ�ѧ����ʽΪ______��
(5)��50t��MoS2Ϊ80%�ķϼ��������������ȡ�����롢�ᴿ���õ�30.9t Na2MoO4����Na2MoO4�IJ���Ϊ______��
���𰸡�+6 500 2MoS2+7O2![]() 2MoO3+4SO2 14 MoO3+Na2CO3
2MoO3+4SO2 14 MoO3+Na2CO3![]() Na2MoO4+CO2�� 60%
Na2MoO4+CO2�� 60%
��������
�������̣������б��շϼ��������MoS2ȼ�շ�Ӧ����ʽΪ2MoS2+7O2![]() 2MoO3+4SO2����Na2CO3���Ա��գ��ټ�ˮ�ܽ����������Һ��Ȼ������Һ�м���ϡ�������pHֵ�����ˣ���Һ�е�����ΪNa2MoO4�����Լ�̼���Ƽ��Ա���ʱ��Ҫ�ǽ�MoO3ת��Ϊ������ˮ��Na2MoO4����Ӧ�Ļ�ѧ����ʽΪMoO3+Na2CO3
2MoO3+4SO2����Na2CO3���Ա��գ��ټ�ˮ�ܽ����������Һ��Ȼ������Һ�м���ϡ�������pHֵ�����ˣ���Һ�е�����ΪNa2MoO4�����Լ�̼���Ƽ��Ա���ʱ��Ҫ�ǽ�MoO3ת��Ϊ������ˮ��Na2MoO4����Ӧ�Ļ�ѧ����ʽΪMoO3+Na2CO3![]() Na2MoO4+CO2��������Һ����Ũ������ȴ�ᾧ���õ�Na2MoO42H2O���壬�ٷֽ�õ�Na2MoO4���ݴ˷�������
Na2MoO4+CO2��������Һ����Ũ������ȴ�ᾧ���õ�Na2MoO42H2O���壬�ٷֽ�õ�Na2MoO4���ݴ˷�������
(1)����Na2MoO4�л��ϼ۴�����Ϊ0��MoԪ�صĻ��ϼ�Ϊ+��2��4-1��2��=+6�ۣ�
�ʴ�Ϊ��+6��
(2)�ɷϼ����������Ŀ�����ѳ�������֬����ȣ���ϱ���ʵ�����ݿ�֪��500�����ղеİٷֺ����������䣬���Էϼ������Ԥ�����¶�Ӧѡ��500�����ʴ�Ϊ��500��
(3)�����б��շϼ��������MoS2ȼ�շ�Ӧ����MoO3�Ļ�ѧ����ʽΪ2MoS2+7O2![]() 2MoO3+4SO2����Ӧ��MoԪ�ػ��ϼ���+4�����ߵ�+6��SԪ�ػ��ϼ���-2���ߵ�+4�����ɷ���ʽ��֪ת�Ƶ�����Ϊ2����6-4+2��6��=28e-�����Ե�����1mol MoO3ת�Ƶ�����Ϊ14NA��
2MoO3+4SO2����Ӧ��MoԪ�ػ��ϼ���+4�����ߵ�+6��SԪ�ػ��ϼ���-2���ߵ�+4�����ɷ���ʽ��֪ת�Ƶ�����Ϊ2����6-4+2��6��=28e-�����Ե�����1mol MoO3ת�Ƶ�����Ϊ14NA��
�ʴ�Ϊ��2MoS2+7O2![]() 2MoO3+4SO2��14��
2MoO3+4SO2��14��
(4)��̼���Ƽ��Ա���ʱ��Ҫ�ǽ�MoO3ת��Ϊ������ˮ��Na2MoO4����Ӧ�Ļ�ѧ����ʽΪMoO3+Na2CO3![]() Na2MoO4+CO2����
Na2MoO4+CO2����
�ʴ�Ϊ��MoO3+Na2CO![]() Na2MoO4+CO2����
Na2MoO4+CO2����
(5)��50t��MoS2Ϊ80%�ķϼ����������MoS2�����ʵ���Ϊ![]() =2.5��105mol������Moԭ���غ�n��Mo��=n��MoS2��=n��Na2MoO4��������Na2MoO4�IJ���=
=2.5��105mol������Moԭ���غ�n��Mo��=n��MoS2��=n��Na2MoO4��������Na2MoO4�IJ���=![]() ��100%=60%���ʴ�Ϊ��60%��
��100%=60%���ʴ�Ϊ��60%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �е㣺�ڶ��ױ�>����ױ�>�Զ��ױ�
B. �����[��NH4Cl��Һ���ܷ������������Dz��ܺ����ᷢ����ѧ��Ӧ
C.  �л���A�ķ���ʽΪC16H16O3
�л���A�ķ���ʽΪC16H16O3
D.  ��������KMnO4��Һ����ɫ��ȥ����֤����ṹ�д���̼̼˫��
��������KMnO4��Һ����ɫ��ȥ����֤����ṹ�д���̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Cl2����ͨ��ˮ�������ͣ�Ȼ�������еμ�0.1mol/LNaOH��Һ������ʵ���������Һ��pH�仯������ͼ��ʾ�������Ǵ�����ֽ⣬����������ȷ����

A.ʵ���������pH��ֽ�ⶨ��Һ��pH
B.a��b�Σ���Һ��![]() ��С
��С
C.b���Ӧ��Һ�У�c��Cl������c��H+����c��HClO����c��ClO������c��OH����
D.c���Ӧ��Һ�У�c��Na+��=c��Cl-��+c��ClO-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.ˮ�����ӻ�![]() ֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶�
ֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶�
B.![]() ���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й�
���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й�
C.�����£���![]() ��
��![]() ��Һ�м�������
��Һ�м�������![]() ���壬��ʹ��Һ��pH��С��
���壬��ʹ��Һ��pH��С�� �ı�ֵ����
�ı�ֵ����
D.�����£�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��Һ�е�c
��Һ�е�c![]() ��
��![]() �е�
�е�![]() ���
���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��Cʱ��Ksp[Mg(OH)2]=5.61��10-12��Ksp[MgF2]=7.42��10-11,����˵����ȷ����
A.25��Cʱ������Mg(OH)2��Һ�뱥��MgF2��Һ��ȣ�ǰ�ߵ�c(Mg2+)��
B.25��Cʱ����Mg(OH)2������Һ����������NH4Cl���壬c(Mg2+)����
C.25��Cʱ��Mg(OH)2������20mL 0.01 mol/L��ˮ�е�Ksp����20mL 0.01mol/L NH4Cl��Һ�е�KspС
D.25��Cʱ����Mg(OH)2������Һ����ŨNaF��Һ��Mg(OH)2������ת����ΪMgF2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����������ʯī������ʢ�б���NaCl��Һ��U���У����з�����ȷ���ǣ� ��
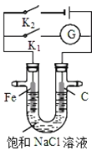
A.K1�պϣ�ʯī����Χ��ҺpH����
B.K1�պϣ������Ϸ����ķ�ӦΪ2H+ + 2e= H2��
C.K2�պϣ��������ᱻ��ʴ��������������������
D.K2�պϣ���·��ͨ��0.2NA������ʱ�����������������4.48L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������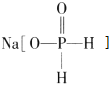 ���������ƣ����л�ѧ��ͭ����Ӧ�Ļ�ѧ����ʽΪ CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2��������˵����ȷ���ǣ�������
���������ƣ����л�ѧ��ͭ����Ӧ�Ļ�ѧ����ʽΪ CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2��������˵����ȷ���ǣ�������
A.��ѧ��Ӧ�У���ԭ����ΪCu��H2
B.CuSO4��Һ������Ũ�ȵĴ�С˳��Ϊc��SO42-����c��Cu2+����c��OH-����c��H+��
C.��Һ��H2PO2-�ĵ��뷽��ʽΪH2PO2-H++HPO22-
D.NaH2PO3�����NaOH��Ӧ����Na2HPO3���ж�H3PO3Ϊ��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���Ӧ2NO2��g��N2O4��g����H<0,�ﵽƽ��ʱNO2������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��������
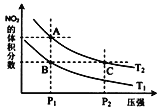
A.�¶ȣ�T1>T2
B.A��B�����Ӧ��ƽ�ⳣ����KA>KB
C.A�㣺2v��NO2���� �T v��N2O4����
D.B��C���������ƽ��Ħ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���뻯ѧƽ�����ƣ�����ƽ���ƽ�ⳣ�����������볣������K��ʾ�����±���ij�¶��¼��ֳ�������ĵ���ƽ�ⳣ����
�� | ���뷽��ʽ | ����ƽ�ⳣ��K |
CH3COOH | CH3COOH | 2��10-5 |
HClO | HClO | 3.0��10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4��10-7 K2=5.6��10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1��10-3 K2=6.3��10-8 K3=4.2��10-13 |
�ش��������⣺
��1������CH3COOH��HClO��H2CO3��HCO3-��H3PO4��H2PO4-��HPO42-���������ᣬ������������ǿ����___________���ѧʽ����
��2����NaClO��Һ��ͨ�������Ķ�����̼�����������ӷ���ʽΪ________��
��3�����¶���0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ���������__��
A c��H+�� B c��H+��c��CH3COO![]()
��4��ȡ�������pH��Ϊa�Ĵ���ʹ���������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һǡ���кͣ����ĵ�NaOH��Һ������ֱ�ΪV1��V2�����С��ϵΪ��V1_________V2����������������������=������
��5�������������ӽ��H+������ǿ����________��
A HCO3- B CO32- C ClO- D CH3COO-
��6�������ʵ����Ŀ����Ʒֱ���pHΪ2��3�Ĵ�����Һ�кͣ������Ĵ�����Һ���������ΪVa��Vb�������ߵĹ�ϵ��ȷ����_________��
A Va��10Vb B Va��10Vb C Vb��10Va D Vb��10Va
��7����֪100��ʱ��ˮ�����ӻ�����Kw=1.0��10-12��pH=3��CH3COOH��pH=9��NaOH��Һ�������ϣ������Һ��_____________�ԣ�
��8����Ũ�ȵĢ٣�NH4��2SO4����NH4HSO4����NH4HCO3����NH4Cl����NH3H2O��Һ�У�NH4+Ũ���ɴ�С��˳���ǣ�_________��
��9��������¶���CH3COONa��ˮ��ƽ�ⳣ��Kh_________��
��10�����ʵ���Ũ����ͬ��������Һ��a CH3COONa��b NaHCO3��c NaClO��d Na2CO3
������Һ��pH��С�������е�˳����____________���ñ����д����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com